Hóa học 12 Bài 22: Luyện tập Tính chất của kim loại
Nội dung bài học ôn tập, hệ thống hóa kiến thức về tính chất vật lý, hóa học của kim loại và vận dùng vào việc giải các bài tập liên quan đến kim loại.
Mục lục nội dung

1. Tóm tắt lý thuyết
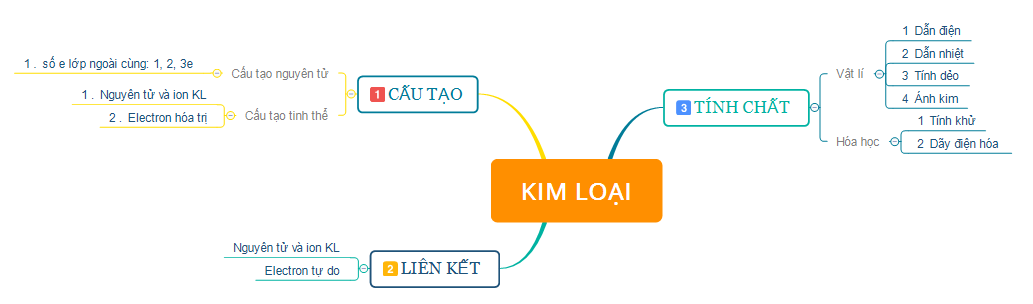
2. Bài tập minh họa
2.1. Dạng 1: Kim loại tác dụng với axit
- Với dung dịch HCl, H2SO4 loãng: Các kim loại đứng trước H trong dãy hoạt động hóa học sẽ phản ứng sinh ra muối + khí H2
- Với H2SO4 đặc nóng, HNO3: Hầu hết các kim loại ( trừ Au, Pt) bị oxi hóa lên mức oxi hóa cao nhất
- Al, Cr, Fe bị thụ động bởi HNO3, H2SO4 đặc nguội
Chú ý:
+ Nên sử dụng phương trình ion để giải các bài toàn
+ Với dạng bài này nên vận dụng các định luật bảo toàn khối lượng, bảo toàn e để giải toán
+ Khi NO3- trong môi trường axit có tính oxi hóa mạnh như HNO3
Bài 1: Hỗn hợp X gồm Cu và kim loại M hóa trị II. Cho X tác dụng với dung dịch HCl dư thu được 11,2l khí (đktc), chất rắn Y nặng 10g và dung dịch Z. Thêm NaOH dư vào Z thu được kết tủa T. Nung T đến khối lượng không đổi thu được 20g chất rắn. Kim loại M và khối lượng hỗn hợp X là:
A. Mg và 30g
B. Mg và 22g
C. Fe và 38g
D. Zn và 42,5g
Hướng dẫn giải
M + 2HCl → MCl2 + H2
0,5 0,5 mol
M (+HCl) → MCl2 (+ NaOH) → M(OH)2 (nung) → MO
0,5 0,5
mMO = 0,5.(16 + M) = 20 → M = 24 (Mg)
→ Đáp án B
Bài 2: Cho a gam bột nhôm tác dụng hết với dung dịch HNO3 loãng thì thu được 0,896l (đktc) khí X gồm N2O và NO có tỉ khối hơi so với hiđro bằng 18,5. Gía trị của a là:
A. 19,80g
B. 18,90g
C. 1,98g
D. 1,89g
Hướng dẫn giải
Dựa vào sơ đồ đường chéo ta tính được nN2O = nNO = 0,02 mol
ne nhận = 8nN2O + 3nNO = 0,22mol = ne nhận = 3nAl
⇒ a = mAl = 1,98
→ Đáp án C
2.2. Dạng 2: Kim loại tác dụng với muối
Bài 1: Nhúng một lá kim loại M ( hóa trị II) nặng 56g vào dd AgNO31M sau một thời gian lấy lá kim loại M ra rửa sạch sấy khô cân lại thấy khối lượng kim loại nặng 54g và thấy thể tích dung dịch AgNO3 dùng hết 200ml . Kim loại M là:
A. Mg
B. Zn
C. Cu
D. Fe
Hướng dẫn giải
M + 2AgNO3 → M(NO3)2 + 2Ag
nAgNO3 = 0,2 mol =nAg ⇒ nM = 0,1 mol
mkim loại giảm = mM pư – mAg sinh ra = 0,1.M – 0,2.108 = 2
⇒ M = 64 (Cu)
→ Đáp án C
Bài 2: Cho hỗn hợp kim loại gồm Al, Fe vào dung dịch Y gồm 2 muối Cu(NO3)2 và AgNO3, sau phản ứng thu được chất rắn Z gồm 3 kim loại. 3 kim loại đó là:
A. Al, Fe, Cu
B. Al, Fe, Cu
C. Ag, Cu, Fe
D. Cu, Ag, Fe
Hướng dẫn giải
Sau khi Al phản ứng hết với muối thì Fe sẽ phản ứng vì Z gồm 3 kim loại nên Fe dư và 2 kim loại được đẩy ra khỏi muối là Ag và Cu
→ Đáp án D
2.3. Dạng 3: Kim loại tác dụng với nước
Hòa tan hoàn toàn 8,94g hỗn hợp gồm Na, K và Ba vào nước thu được dung dịch X và 2,688l H2 (đktc). Dung dịch Y gồm HCl và H2SO4, tỉ lệ mol tương ứng là 4:1. Trung hòa dung dịch X bởi dung dịch Y, tổng khối lượng các muối được tạo ra là:
A. 13,70g
B. 18,46g
C. 12,78g
D. 14,62g
Hướng dẫn giải
Ta có nH2 = 0,12 mol ⇒ nOH- = 2nH2 = 0,24 mol
Ta có: nOH- = nH+ = nHCl + 2 nH2SO4 = 0,24
Mà nHCl : nH2SO4 = 4 : 1
⇒ nHCl = 0,16mol; nH2SO4 = 0,04
mmuối = mkim loại + mgốc axit = mkim loại + mSO42- + mCl-
mmuối = 8,94 + 0,04.96 + 0,16.35,5 = 18,46g
→ Đáp án B
2.4. Dạng 4: Bài tập điện phân
Điện phân 400ml dung dịch 2 muối KCl và CuCl2 với điện cực trơ và màng ngăn cho đến khi ở anot thoát ra 3,36l khí (đktc) thì ngừng điện phân. Để trung hòa dung dịch sau điện phân cần 100ml dung dịch HNO3 0,6M. Dung dịch sau trung hòa tác dụng AgNO3 dư sinh ra 2,87g kết tủa trắng. Nồng độ mol của mối muỗi trong dung dịch trước điện phân là:
A. [CuCl2] = 0,3M; [KCl] = 0,02M
B. [CuCl2]=0,25M; [KCl] = 3M
C. [CuCl2] = 2,5M; [KCl]=0,3M
D. [CuCl2]=0,3M; [KCl]=0,2M
Hướng dẫn giải
(K): K+, Cu2+, H2O (A): Cl-, H2O
Dung dịch sau khi điện phân được trung hòa bằng HNO3; nHNO3 = 0,06
⇒ Ở (K) sau khi Cu2+ điện phân hết, xảy ra sự điện phân của H2O
Cu2+ +2e → Cu
H2O + e → OH- + 1/2H2
nOH- = nHNO3 = 0,06 mol
Dung dịch sau điện phân tạo kết tủa với AgNO3, nAgCl = 0,02 mol
⇒ Ở (A) Cl- chưa bị điện phân hết
Khí thoát ra ở (A) là Cl2, n Cl2 = 0,15mol
2Cl- → Cl2 + 2e
ne cho = 2nCl2 = 0,3 = ne nhận = nOH- + 2nCu2+
⇒ nCu2+ =nCuCl2= 0,12mol ⇒ [CuCl2] = 0,12 : 0,4 = 0,3M
nCl- = 2 nCl2 + nAgCl = 0,32 = nKCl + 2 nCuCl2
⇒ nKCl = 0,08 ⇒ [KCl] = 0,08 : 0,4 = 0,2M
→ Đáp án D
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Cho hỗn hợp X gồm Fe, Cu vào dung dịch HNO3 loãng, nóng thu được khí NO, dung dịch Y và còn lại chất rắn chưa tan Z. Cho Z tác dụng với dung dịch H2SO4 loãng thấy có khí thoát ra. Thành phần chất tan trong dung dịch Y là?
Câu 2: Cho 1,68 gam bột Fe vào 100 ml dung dịch X gồm AgNO3 0,1M và Cu(NO3)2 xM. Khuấy nhẹ cho tới khi phản ứng kết thúc thu được dung dịch Y và 2,58 gam chất rắn z. Giá trị của x là?
Câu 3: Cho 8,3 gam hỗn hợp X gồm Al, Fe (nAl = nFe) vào 100 ml dung dịch Y gồm Cu(NO3)2 và AgNO3. Sau khi phản ứng kết thúc thu được chất rắn Y gồm 3 kim loại. Hòa tan hoàn toàn chất rắn Y vào dung dịch HCl dư thấy có 1,12 lít khí thoát ra (đktc) và còn lại 28 gam chất rắn không tan Z. Nồng độ mol của Cu(NO3)2 và của AgNO3 lần lượt là?
Câu 4: Hòa tan hoàn toàn 100 gam hỗn hợp X gồm Fe, Cu, Ag trong dung dịch HNO3 (dư). Kết thúc phản ứng thu được 13,44 lít hỗn hợp khí Y gồm NO2, NO, N2O theo tỉ lệ số mol tương ứng là 3: 2: 1 và dung dịch Z (không chứa muối NH4NO3). Cô cạn dung dịch Z thu được m gam muối khan. Giá trị của m và số mol HNO3 đã phản ứng lần lượt là?
Câu 5: Lấy 14,3g hỗn hợp X gồm Mg, Al, Zn đem đốt nóng trong oxi dư, sau khi phản ứng xảy ra hoàn toàn thì nhận được 22,3g hỗn hợp Y gồm 3 oxit. Tính thể tích dung dịch HCl 2M tối thiểu cần dùng để hòa tan hỗn hợp Y?
3.2. Bài tập trắc nghiệm
Câu 1: Nhận xét nào về tính chất vật lí của kim loại dưới đây là không đúng?
A. Nhiệt độ nóng chảy: Hg < Al < W.
B. Tính cứng: Cs < Fe < W < Cr
C. Tính dẫn điện và nhiệt: Fe < Al < Au < Cu < Ag.
D. Tính dẻo: Al < Au < Ag.
Câu 2: Cho các phản ứng sau:
X + HNO3(đặc, nóng) → A + NO2 + H2O
A + Cu → X + D
X có thể là kim loại nào trong số các kim loại sau?
A. Zn
B. Fe
C. Pb
D. Ag
Câu 3: Cho các kim loại: Cu, Fe, Ag và các đung dịch HCl, CuSO4, FeCl2, FeO3. Số cặp chất có phản ứng với nhau là
A. 2.
B. 3.
C. 4.
D. 5.
Câu 4: Cho hỗn hợp bột Al và Zn vào dung dịch chứa Cu(NO3)2 và AgNO3 sau phản ứng thu được dung dịch A gồm hai muối và hai kim loại. Hai muối trong dung dịch A là:
A. Zn(NO3)2 và AgNO3.
B. Al(NO3)3 và Cu(NO3)2.
C. Al(NO3)3 và Zn(NO3)2.
D. Al(NO3)3 và AgNO3.
Câu 5: Các phát biểu sau đây Đúng hay Sai? Vì sao?
a. Kim loại có độ cứng lớn nhất là Cr.
b. Kim loại dẫn điện tốt nhất là Cu.
c. Kim loại có nhiệt độ nóng chảy cao nhất là W.
d. Kim loại có khối lượng riêng nhỏ nhất là Li.
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Luyện tập Tính chất của kim loại Hóa học 12 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Qua nội dung bài luyện tập này các em sẽ được hệ thống lại kiến thức đã học và làm quen với nhiều dạng bài tập khác nhau.
- Tính chất vật lý, tính chất hóa học của kim loại.
- Vận dụng nội dung ôn tập để giải các bài tập liên quan.
Tham khảo thêm
- docx Hóa 12 Bài 17: Vị trí của kim loại trong BTH và cấu tạo của kim loại
- docx Hóa học 12 Bài 18: Tính chất của kim loại và dãy điện hóa của kim loại
- docx Hóa học 12 Bài 19: Hợp kim
- docx Hóa học 12 Bài 20: Sự ăn mòn kim loại
- docx Hóa học 12 Bài 21: Điều chế kim loại
- docx Hóa học 12 Bài 23: Luyện tập Điều chế kim loại và sự ăn mòn kim loại
- docx Hóa học 12 Bài 24: Thực hành Tính chất, điều chế kim loại, sự ăn mòn kim loại
