Hoá học 12 Bài 38: Luyện tập Tính chất hóa học của crom, đồng và hợp chất của chúng
Nội dung bài học lí giải cấu hình electron bất thường của nguyên tử Crom, đồng và các số oxi hóa thường gặp của chúng. Ngoài ra, các em sẽ được rèn luyện kĩ năng giải các bài tập, dạng toán quan trọng liên quan đến Crom, Đồng.
Mục lục nội dung

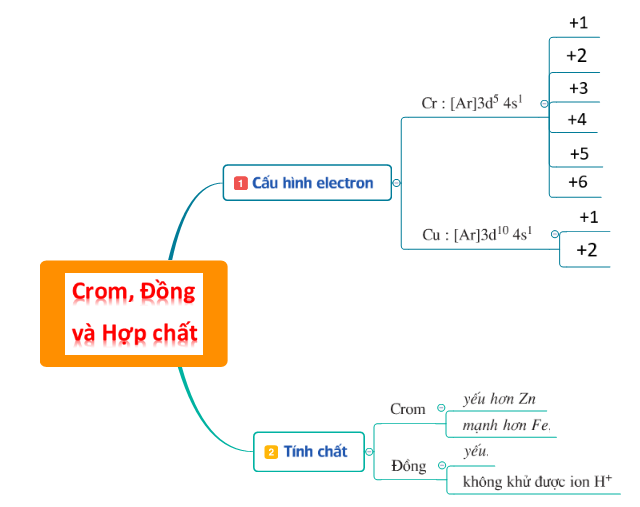
1. Tóm tắt lý thuyết
2. Bài tập minh họa
2.1. Dạng 1: Bài tập crom tác dụng với axit
Bài 1: Hòa tan m gam Crom trong dung dịch HCl dư, sau khi phản ứng kết thúc thu được 4,48 lít khí H2 (đktc). Giá trị của m là?
Hướng dẫn giải
Ta có: nH2 = 0,2 mol
Cr + 2HCl → CrCl2 + H2↑
0,2 0,2mol
→ mCr = 0,2. 52 = 10,4 gam
Bài 2: Hòa tan a gam crom trong dung dịch H2SO4 loãng, nóng thu được dung dịch X và 3,36 lit khí (đktc). Cho X tác dụng với dung dịch NaOH dư trong không khí đến khối lượng không đổi. Lọc, đem nung đến khối lượng không đổi thì lượng chất rắn thu được là?
Hướng dẫn giải
Ta có sơ đồ chuyển hóa của Cr:
Cr → Cr2+ → Cr(OH)2 → Cr(OH)3 → Cr2O3
nCr = nH2 = 0,15 mol → nCr2O3 = 0,5 nCr = 0,5. 0,15 = 0,075 mol
→ mCr2O3 = 11,4 gam
2.2. Dạng 2: Bài tập về tính khử của hợp chất crom (II)
Hòa tan hết 1,56 gam bột crom vào 550 ml dung dịch HCl 0,2M đun nóng thu được dung dịch A. Sục O2 dư vào A thu được dung dịch B. Tính thể tích dung dịch NaOH 0,5M cần thêm vào dung dịch B để thu được lượng kết tủa lớn nhất.
Hướng dẫn giải
nCr = 1,56/52 = 0,03 mol; nHCl = 0,55. 0,2 = 0,11 mol
Cr + 2HCl → CrCl2 + H2
(mol): 0,03 0,06 0,03 0,03
4CrCl2 + O2 + 4HCl → 4CrCl3 + H2O
(mol): 0,03 0,03 0,03
Dung dịch A thu được gồm: CrCl3 = 0,03 mol; HCl = 0,11 - 0,09 = 0,02 mol
Để thu được lượng kết tủa lớn nhất:
HCl + NaOH → NaCl + H2O
(mol): 0,02 0,02
CrCl3 + 3NaOH → Cr(OH)3 + 3NaCl
(mol): 0,03 0,09 0,03
Thể tích dung dịch NaOH cần dùng = (0,02+0,09)/0,5 = 0,22 (l)
2.3. Dạng 3: Bài tập Tính lưỡng tính của hợp chất Crom (III)
Nung hỗn hợp bột gồm 15,2g Cr2O3 và m (g) Al ở nhiệt độ cao. Sau khi phản ứng hoàn toàn, thu được 23,3g hỗn hợp rắn X. Cho toàn bộ hỗn hợp X phản ứng với axit HCl dư thoát ra V (l) khí H2 (đktc). Giá trị của V là:
A. 4,48 lít
B. 7,84 lít
C. 10,08 lít
D. 3,36 lít
Hướng dẫn giải
Chọn đáp án B
Ta có: nCr2O3 = 15,2/152 = 0,1 mol
Áp dụng định luật bảo toàn khối lượng:
MAl = mhh - mCr2O3 = 23,3 - 15,2 = 8,1 (g) → nAl = 8,1/27 = 0,3 mol
Phản ứng: 2Al + Cr2O3 → 2Cr + Al2O3
0,2 0,1 0,2 0,1
Vậy hỗn hợp X gồm: Al dư: 0,3 - 0,2 = 0,1 mol; Cr: 0,2 mol; Al2O3: 0,1 mol.
Hỗn hợp X + dung dịch HCl:
2Al + 6HCl → 2AlCl3 + 3H2
0,1 0,15
Cr + 2HCl → CrCl2 + H2
0,2 0,2
⇒ nH2 = 0,15 + 0,2 = 0,35 mol → VH2 = 7,84 lít
2.4. Dạng 4: Tính oxi hóa của hợp chất Crom (VI)
Cho 17g H2S tác dụng hết với dung dịch K2Cr2O7 trong axit sunfuric thì thu được 1 đơn chất. Tính khối lượng đơn chất thu được?
A. 16g
B. 32g
C. 4,8g
D. 8g
Hướng dẫn giải
Chọn đáp án A
K2Cr2O7 + 3H2S + H2O → 2Cr(OH)3 + 3S + 2KOH
nH2S = 0,5 mol
nS = nH2S = 0,5 mol → mS = 0,5. 32 = 16g
2.5. Dạng 5: Bài tập Đồng (Cu) tác dụng với axit sunfuric (H2SO4) đặc nóng, axit nitric (HNO3)
Bài 1: Hòa tan 6,4 gam Cu bằng axit H2SO4 đặc, nóng (dư), sinh ra V lít khí SO2 (sản phẩm khử duy nhất, ở (đktc). Giá trị của V là:
Hướng dẫn giải
Ta có: nCu = 0,1 mol
Áp dụng bảo toàn electron: 2nCu = 2nSO2
→ nSO2 = 0,1 mol
→ VSO2 = 2,24 lít
Bài 2: Cho m gam Cu phản ứng hết với dung dịch HNO3 thu được 8,96 lít (đktc) hỗn hợp khí NO và NO2 có tỉ khối đối với H2 là 19. Giá trị của m là:
Hướng dẫn giải
Đặt u, v là số mol NO và NO2.
→ u + v = 0,4 mol
mkhí = 30u + 46v = 0,4. 2. 19
→ u = v = 0,2 mol
Bảo toàn electron: 2nCu = 3nNO + nNO2
→ nCu = 0,4 mol
→ mCu = 25,6 gam
2.6. Dạng 6: Đồng (Cu), hợp chất của đồng tác dụng với axit
Bài 1: Khi hòa tan 30 gam hỗn hợp Cu và CuO trong dung dịch HNO3 1M lấy dư, thấy thoát ra 6,72 lít khí NO (sản phẩm khử duy nhất, ở đktc). Khối lượng của CuO trong hỗn hợp ban đầu là:
Hướng dẫn giải
nNO = 0,3 mol
Bảo toàn e: 2nCu = 3nNO
→ nCu = 0,45 mol → mCu = 0,45. 64 = 28,8 gam
→ mCuO = 1,2 gam.
Bài 2: Cho 1 lượng bột Cu dư vào 200ml hỗn hợp HNO3 1M và H2SO4 0,5M, sau khi phản ứng xảy ra hoàn toàn thu được dung dịch X và sản phẩm khử duy nhất là NO. Cô cạn dung dịch C, khối lượng muối khan thu được là:
Hướng dẫn giải
Vì chỉ sinh ra khí NO nên ta có:
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O.
0,4 0,1 0,15
Nên sau khi cô cạn dung dịch X ta có: 0,15 mol Cu2+; 0,1 mol NO3-; 0,1 mol SO42-
→ mmuối khan = 25,4 gam
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Hoàn thành sơ đồ phản ứng sau:
a. Cr2O3 → Cr → Cr2(SO4)3 → Cr(OH)3 → Na[Cr(OH)4]
b. CrCl3 → K2CrO4 → K2Cr2O7 →Cr2(SO4)3 → CrSO4 → Cr(OH)2
Câu 2: Dung dịch X gồm CuCl2 0,2M; FeCl2 0,3M; FeCl3 0,3M. Cho m (g) bột Mg vào 100ml dung dịch X khuấy đều đến khi phản ứng kết thúc thu được dung dịch B. Thêm dung dịch KOH dư vào B được kết tủa D. Nung D trong không khí đến khối lượng không đổi thu được 5,4 g chất rắn E. Giá trị của m là?
Câu 3: Hòa tan hỗn hợp gồm 0,1 mol Zn; 0,05 mol Cu; 0,3 mol Fe trong dung dịch HNO3. Sau khi các kim loại tan hết thu được dung dịch không chứa NH4NO3 và khí NO là sản phẩm khử duy nhất, Số mol HNO3 tối thiểu cần dùng là?
Câu 4: Dung dịch X chứa m gam hỗn hợp CuSO4 và NaCl. Thực hiện điện phân dung dịch X cho đến khi nước bắt đầu điện phân ở cả 2 điện cực thì dừng lại, khi đó ở anot thoát ra 4,48 lít khí (đktc). Dung dịch sau điện phân có thể hòa tan tối đa 2,7 gam Al. Giá trị lớn nhất của m là:
Câu 5: Thực hiện các phản ứng nhiệt nhôm hỗn hợp gồm m gam Al và 4,56 gam Cr2O3 (trong điều kiện không có O2), sau khi phản ứng kết thúc, thu được hỗn hợp X. Cho toàn bộ X vào một lượng dư dung dịch HCl (loãng, nóng), sau khi các phản ứng xảy ra hoàn toàn, thu được 2,016 lít H2 (đktc). Còn nếu cho toàn bộ X vào một lượng dư dung dịch NaOH (đặc, nóng), sau khi phản ứng kết thúc thì số mol NaOH đã phản ứng là:
3.2. Bài tập trắc nghiệm
Câu 1: Cho m gam bột crom phản ứng hoàn toàn với dung dịch HCl (dư) thu được V lít khí H2 (đktc). Mặt khác cũng m gam bột crom trên phản ứng hoàn toàn với khí O2 (dư) thu được 15,2 gam oxit duy nhất. Giá trị của V là:
A. 2,24
B. 4,48
C. 3,36
D. 6,72
Câu 2: Cho 3,2 gam Cu tác dụng với 100ml dung dịch hỗn hợp (HNO3 0,8M + H2SO4 0,2M), sản phẩm khử duy nhất của HNO3 là NO. Thể tích khí NO (đktc) là
A. 0,672 lít.
B. 0,336 lít.
C. 0,747 lít.
D. 1,792 lít.
Câu 3: Cặp chất nào sau đây phản ứng với cả 2 dung dịch HCl và NaOH?
A. Al2O3 và CrO3.
B. Cr2O3 và Al2O3.
C. CrO và Al2O3.
D. CrO và Cr2O3.
Câu 4: Tính chất hóa học đặc trưng của các hợp chất Crom (II) là
A. tính khử.
B. Tính oxi hóa.
C. Tính lưỡng tính.
D. Tính axit.
Câu 5: Có các cặp chất sau: Cu và dung dịch FeCl3; H2S và dung dịch CuSO4; H2S và dung dịch FeCl3; dung dịch AgNO3 và dung dịch FeCl3. Số cặp chất xảy ra phản ứng ở điều kiện thường là:
A. 2
B. 3
C. 4
D. 1
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Luyện tập Tính chất hóa học của crom, đồng và hợp chất của chúng Hóa học 12 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Trong nội dung bài học này các em cần nắm bắt một số thứ như sau: tính chất của crom, đồng và hợp chất của chúng.
Tham khảo thêm
- docx Hoá học 12 Bài 31: Sắt
- pdf Hóa học 12 Bài 32: Hợp chất của sắt
- pdf Hoá học 12 Bài 33: Hợp kim của sắt
- docx Hóa học 12 Bài 34: Crom và hợp chất của Crom
- docx Hóa học 12 Bài 35: Đồng và hợp chất của Đồng
- docx Hóa học 12 Bài 36: Sơ lược về Niken, Kẽm, Chì, Thiếc
- docx Hóa học 12 Bài 37: Luyện tập Tính chất hóa học của sắt và hợp chất của sắt
- docx Hoá học 12 Bài 39: Thực hành Tính chất hóa học của sắt, đồng và hợp chất của sắt, crom
