Giải bài tập SGK Hóa 12 Nâng cao Bài 41: Một số hợp chất của sắt
Hướng dẫn Giải bài tập Hóa học 12 nâng cao Bài 41 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về tính chất của một số hợp chất của sắt. Mời các em cùng theo dõi.
Mục lục nội dung

1. Giải bài 1 trang 202 SGK Hóa 12 nâng cao
a. Tính chất hóa học chung của hợp chất sắt (II) là gì? Dẫn ra những phản ứng hóa học để chứng minh những điều đã khẳng định (viết phương trình hóa học)
b. Tính chất hóa học chung cho hợp chất sắt (III) là gì? Dẫn ra những phản ứng hóa học để chứng minh những điều khẳng định (viết phương trình hóa học)
Phương pháp giải
Để trả lời câu hỏi trên cần nắm rõ tính chất hóa học của hợp chất sắt (II) và hợp chất sắt (III)
Hướng dẫn giải
Câu a: Tính chất hóa học chung của hợp chất sắt (II)
Hợp chất Fe(II) vừa có tính oxi hóa, vừa có tính khử:
- Tính khử :
2FeCl2 + Cl2 \(\xrightarrow{{{t^o}}}\) 2FeCl3
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
- Tính oxi hóa:
Zn + FeSO4 → Fe + ZnSO4
Câu b: Tính chất hóa học chung cho hợp chất sắt (III)
Hợp chất Fe(III) có tính oxi hóa :
Fe2O3 + CO \(\xrightarrow{{{t^o}}}\) 2FeO + CO2
Fe2(SO4)3 + Cu → 2FeSO4 + CuSO4
2. Giải bài 2 trang 202 SGK Hóa 12 nâng cao
Hãy dẫn ra những phản ứng hóa học để chứng minh rằng các oxit sắt (II) là oxit bazơ, các hiđroxit sắt (II) là bazơ (Viết các phương trình phản ứng hóa học).
Phương pháp giải
Để viết các phương trình phản ứng hóa học cần nắm rõ tính chất hóa học của oxit sắt (II), hiđroxit sắt (II).
Hướng dẫn giải
Những phản ứng hóa học chứng minh rằng các oxit sắt (II) là oxit bazơ, các hiđroxit sắt (II) là bazơ:
FeO + 2HCl → FeCl2 + H2O
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
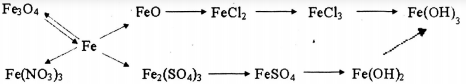
3. Giải bài 3 trang 202 SGK Hóa 12 nâng cao
Viết các phương trình hóa học biểu diễn những chuyển đổi hóa học sau:
Phương pháp giải
Dựa vào chất sản phẩm và chất tham gia phản ứng để suy ra các chất còn lại và viết phương trình hóa học.
Hướng dẫn giải
Các phương trình hóa học của dãy chuyển hóa trên:
3Fe + 2O2 \(\xrightarrow{{{t^o}}}\) Fe3O4
3Fe3O4 + 8Al \(\xrightarrow{{{t^o}}}\) 4Al2O3 + 9Fe
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Fe + H2O \(\xrightarrow[ \ ]{ > \ 570 ^0C }\) FeO + H2
FeO + 2HCl → FeCl2 + H2O
2FeCl2 + Cl2 \(\xrightarrow{{{t^o}}}\) 2FeCl3
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
2Fe + 6H2SO4 đặc \(\xrightarrow[ \ ]{ \ t ^0 }\) Fe2(SO4)3 + 3SO2 + 6H2O
Fe2(SO4)3 + Fe → 3FeSO4
FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
4. Giải bài 4 trang 202 SGK Hóa 12 nâng cao
Hoà tan 10 gam FeSO4 có lẫn tạp chất là Fe2(SO4)3 trong nước, được 200 cm3 dung dịch. Biết 20 cm3 dung dịch này được axit hoá bằng H2SO4 loãng làm mất màu tím của 25 cm3 dung dịch KMnO4 0,03 M.
a) Viết phương trình hoá học dạng ion rút gọn. Cho biết vai trò của ion Fe2+ và ion MnO4-.
b) Có bao nhiêu mol ion Fe2+ tác dụng với 1 mol ion MnO4-?
c) Có bao nhiêu mol ion Fe2+ tác dụng với 25 cm3 dung dịch KMnO4 0,03M?
d) Có bao nhiêu gam Fe2+ trong 200 cm3 dung dịch ban đầu.
e) Tính phần trăm theo khối lượng của FeSO4.
Phương pháp giải
a. Xác định sự thay đổi số oxi hóa của ion Fe2+ và ion MnO4- để viết phương trình hoá học dạng ion rút gọn.
b. Dựa vào hệ số cân bằng để xác định số mol ion Fe2+ tác dụng với 1 mol ion MnO4-
c. Tính số mol ion Fe2+ theo số mol KMnO4 tìm được.
d. Tính số mol Fe2+ trong 200 cm3, suy ra khối lượng Fe2+
e. Tính khối lương FeSO4 tinh khiết, suy ra phần trăm theo khối lượng.
Hướng dẫn giải
Câu a: Viết phương trình hoá học dạng ion rút gọn
5Fe2+ + MnO4- + 8H+ → 5Fe3+ + Mn2+ + 4H2O (Fe2+ là chất khử)
MnO4- + 8H+ + 5e → Mn2+ + 4H2O (MnO4- là chất oxi hóa)
Câu b: Có bao nhiêu mol ion Fe2+ tác dụng với 1 mol ion MnO4-?
Để tác dụng với 1 mol MnO4- cần 5 mol Fe2+.
Câu c: Có bao nhiêu mol ion Fe2+ tác dụng với 25 cm3 dung dịch KMnO4 0,03M?
\({n_{Mn{O_4}^ - }}\) = 0,025.0,03 = 7,5.10-4 (mol)
nFe2+ = 5.nMnO4- = 3,75.10-3 mol.
Câu d: Có bao nhiêu gam Fe2+ trong 200 cm3 dung dịch ban đầu
Số mol Fe2+ trong 200 cm3 là 3,75.10-3.10 = 0,0375 mol
⇒ mFe2+ = 0,0375 . 56 = 2,1 gam.
Câu e: Tính phần trăm theo khối lượng của FeSO4
\({m_{FeS{O_4}}}\) tinh khiết = 0,0374 . 152 = 5,7 gam.
\(\% {m_{FeS{O_4}}} = \frac{{5,7}}{{10}}.100 = 57\;\% \)
Tham khảo thêm
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 38: Crom
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 39: Một số hợp chất của crom
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 40: Sắt
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 42: Hợp kim của sắt
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 43: Đồng và một số hợp chất của đồng
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 44: Sơ lược về một số kim loại khác
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 45: Luyện tập: Tính chất của crom, sắt và những hợp chất của chúng
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 46: Luyện tập: Tính chất của đồng và hợp chất của đồng. Sơ lược về các kim loại Ag, Au, Ni, Zn, Sn, Pb