Giải bài tập SGK Hóa 12 Nâng cao Bài 51: Chuẩn độ axit- bazơ
Hướng dẫn Giải bài tập Hóa học 12 nâng cao Bài 51 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về chuẩn độ axit- bazơ. Mời các em cùng theo dõi.
Mục lục nội dung

1. Giải bài 1 trang 245 SGK Hóa 12 nâng cao
Khái niệm sự chuẩn độ? Khái niệm điểm tương đương? Khái niệm điểm cuối? Cho thí dụ minh hoạ?
Phương pháp giải
Để trả lời các câu hỏi trên cần nắm rõ lý thuyết về chuẩn độ axit- bazơ.
Hướng dẫn giải
- Sự chuẩn độ là cách xác định nồng độ của dung dịch.
- Thời điểm mà chất cần xác định nồng độ vừa tác dụng hết với dung dịch chuẩn gọi là điểm tương đương.
- Thời điểm kết thúc chuẩn độ là điểm cuối.
- Ví dụ:
Chuẩn độ dung dịch HCl chưa biết nồng độ bằng dung dịch chuẩn NaOH:
HC + NaOH → NaCl + H2O
Trong quá trình chuẩn độ, pH của dung dịch thay đổi liên tục. Tại điểm tương đương, tức là thời điểm mà dung dịch chuẩn vừa trung hòa hết dung dịch axit hoặc bazơ cần chuẩn độ, pH của dung dịch phụ thuộc vào bản chất của axit hoặc bazơ cần chuẩn độ và nồng độ của chúng. Với phản ứng trên,pH tại thời điểm tương đương là pH của dung dịch NaCl bằng 7 và không phụ thuộc vào nồng độ của NaCl.
2. Giải bài 2 trang 245 SGK Hóa 12 nâng cao
Cần phải thêm bao nhiêu ml dung dịch NaOH 0,25 M vào 50 ml dung dịch hỗn hợp HCl 0,1M và H2SO4 0,05M để thu được dung dịch có độ pH = 2,0?
A. 43,75 ml
B. 36,54 ml
C. 27,75 ml
D. 40,75 ml
Phương pháp giải
- Bước 1: Tính số mol H+ và OH-
- Bước 2: Phản ứng: H+ + OH- → H2O
pH = 2, suy ra axit còn dư
- Bước 3: Tính số mol chất dư, suy ra thể tích.
Hướng dẫn giải
Ta có:
nHCl = 0,005 mol; nH2SO4 = 0,0025 mol
⇒ nH+ = 2.nH2SO4 + nHCl = 0,01 mol.
nOH- = 0,25V (với V là thể tích NaOH thêm vào)
Phản ứng: H+ + OH- → H2O
Dung dịch thu được có pH = 2 ⇒ axit dư
nH+ dư = 0,01 - 0,25V
CM H+ sau phản ứng = \(\frac{{0,01 - 0,25V}}{{0,05 + V}}\) = 10-2 (do pH = 2)
Thể tích NaOH thêm vào là: V = 0,03654 lít = 36,54 ml.
⇒ Đáp án B.
3. Giải bài 3 trang 245 SGK Hóa 12 nâng cao
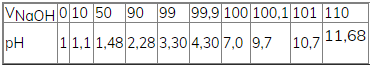
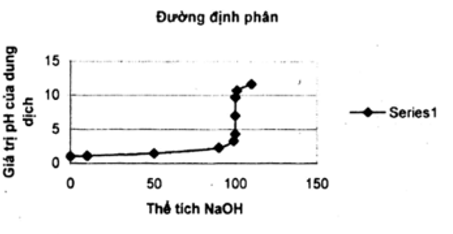
Từ các số liệu sau hãy vẽ đồ thị biểu diễn sự biến thiên pH của dung dịch trong quá trình chuẩn độ dung dịch HCl 0,100 M bằng dung dịch NaOH 0,100 M. Trục hoành ghi thể tích dung dịch NaOH, trục tung ghi pH của dung dịch. Đường biểu diễn trên đồ thị đó gọi là đường định phân.
Phương pháp giải
Để vẽ biểu đồ ta căn cứ vào số liệu đã cho, trục tung là giá trị pH, trục hoành là thể tích NaOH. Nối các điểm giao nhau giữa trcu tung và trục hoành lại với nhau ta được đồ thị.
Hướng dẫn giải
Đồ thị biểu diễn sự biến thiên pH của dung dịch:
Tham khảo thêm
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 48: Nhận biết một số cation trong dung dịch
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 49: Nhận biết một số anion trong dung dịch
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 50: Nhận biết một số chất khí
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 52: Chuẩn độ oxi hóa- khử bằng phương pháp pemanganat
- doc Giải bài tập SGK Hóa 12 Nâng cao Bài 53: Luyện tập nhận biết một số ion trong dung dịch