Giải bài tập SBT Hóa 12 Bài 25: Kim loại kiềm và hợp chất quan trọng của kim loại kiềm
Hướng dẫn Giải bài tập Sách bài tập Hóa học 12 Bài 25 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về cấu tạo, tính chất kim loại kiềm và hợp chất quan trọng của kim loại kiềm. Mời các em cùng theo dõi.
Mục lục nội dung
1. Giải bài 25.1 trang 54 SBT Hóa học 12
2. Giải bài 25.2 trang 54 SBT Hóa học 12
3. Giải bài 25.3 trang 54 SBT Hóa học 12
4. Giải bài 25.4 trang 54 SBT Hóa học 12
5. Giải bài 25.5 trang 55 SBT Hóa học 12
6. Giải bài 25.6 trang 55 SBT Hóa học 12
7. Giải bài 25.7 trang 55 SBT Hóa học 12
8. Giải bài 25.8 trang 55 SBT Hóa học 12
9. Giải bài 25.9 trang 55 SBT Hóa học 12
10. Giải bài 25.10 trang 55 SBT Hóa học 12
11. Giải bài 25.11 trang 56 SBT Hóa học 12
12. Giải bài 25.12 trang 56 SBT Hóa học 12
13. Giải bài 25.13 trang 56 SBT Hóa học 12
14. Giải bài 25.14 trang 56 SBT Hóa học 12
15. Giải bài 25.15 trang 56 SBT Hóa học 12
16. Giải bài 25.16 trang 57 SBT Hóa học 12

1. Giải bài 25.1 trang 54 SBT Hóa học 12
Những nguyên tố trong nhóm IA của bảng tuần hoàn được sắp xếp từ trên xuống dưới theo thứ tự tăng dần của
A. điện tích hạt nhân nguyên tử.
B. khối lượng riêng.
C. nhiệt độ sôi.
D. số oxi hoá.
Phương pháp giải
Dựa vào lí thuyết bài bảng tuần hoàn các nguyên tố hóa học để xác định tính chất của các nguyên tố trong nhóm IA của bảng tuần hoàn từ trên xuống dưới.
Hướng dẫn giải
Những nguyên tố trong nhóm IA của bảng tuần hoàn được sắp xếp từ trên xuống dưới theo thứ tự tăng dần của điện tích hạt nhân nguyên tử
=> Chọn A.
2. Giải bài 25.2 trang 54 SBT Hóa học 12
Cho 3 g hỗn hợp gồm Na và kim loại kiềm M tác dụng với nước. Để trung hoà dung dịch thu được cần 800 ml dung dịch HCl 0,25M. Kim loại M là
A. Li. B. Cs.
C. K. D. Rb.
Phương pháp giải
- Gọi kim loại trung bình \(\overline M \)
- Viết PTHH, số mol HCl => số mol \(\overline M \)
=> Kim loại cần tìm.
Hướng dẫn giải
\({n_{HCl}} = 0,8.0,25 = 0,2mol\)
\(\overline {2M} + {H_2}O \to 2\overline M OH + {H_2}\) (1)
\(\overline M OH + HCl \to \overline M Cl + {H_2}O(2)\) (2)
\({n_{hh}} = {n_{HCl}} = 0,2(mol)\)
\(\overline M = \frac{3}{{0,2}} = 15\)
Nguyên tử khối trung bình là 15 thì phải có một kim loại có NTK < 15 và một kim loại có NTK > 15. Vậy chỉ có Li (M = 7) và Na (M = 23) là phù hợp.
=> Chọn A.
3. Giải bài 25.3 trang 54 SBT Hóa học 12
Cho 4,7 g K2O vào 195,3 g nước. Nồng độ phần trăm của dung dịch thu được là
A.2,6%. B. 6,2%.
C. 2,8%. D. 8,2%.
Phương pháp giải
- Viết phương trình hóa học của phản ứng.
- Tính số mol KOH theo phương trình
- Suy ra nồng độ phần trăm của dung dịch thu được
Hướng dẫn giải
\({K_2}O + {H_2}O \to 2KOH\)
\(C\% = \frac{{56.0,1}}{{4,7 + 195,3}}.100\% = 2,8\% \)
4. Giải bài 25.4 trang 54 SBT Hóa học 12
Cho 17 g hỗn hợp X gồm hai kim loại kiềm đứng kế tiếp nhau trong nhóm IA tác dụng với nước thu đừợc 6,72 lít H2 (đktc) và dung dịch Y.
a) Hỗn hợp X gồm
A. Li và Na. B. Na và K.
C. K và Rb. D. Rb và Cs.
b) Thể tích dung dịch HCl 2M cần để trung hoà dung dịch Y là
A. 200 ml. B. 250 ml.
C. 300 ml. D. 350 ml.
Phương pháp giải
Gọi kim loại trung bình \(\overline M \)
- Viết phương trình hóa học, tính toán theo PTHH => \(\overline M \)=> hai kim loại
- Từ số mol \(\overline M \) => số mol HCl phản ứng => CM HCl
Hướng dẫn giải
\(\overline {2M} + {H_2}O \to 2\overline M OH + {H_2}\)
\({n_X} = 2{n_{{H_2}}} = 2.\frac{{6,72}}{{22,4}} = 0,6(mol)\)
\(\overline M = \frac{{17}}{{0,6}} = 28,3(g/mol)\)
Na (M = 23); K (M = 39)
\({V_{{\text{dd}}\,HCl}} = \frac{{0,6}}{2} = 0,3(l)\)
Chọn B và C.
5. Giải bài 25.5 trang 55 SBT Hóa học 12
Cho 3,9 g kali tác dụng với nước thu được 100 ml dung dịch. Nồng độ mol của dung dịch KOH thu được là
A. 0,1M. B. 0,5M.
C. 1M. D. 0,75M.
Phương pháp giải
- Viết phương trình hóa học, tính toán theo phương trình hóa học
- Tính theo số mol kali => H
Hướng dẫn giải
\(K + {H_2}O \to KOH + \frac{1}{2}{H_2}\)
\({C_M} = \frac{{0,1}}{{0,1}} = 1M\)
Chọn C.
6. Giải bài 25.6 trang 55 SBT Hóa học 12
Cho hỗn hợp Na và Mg lấy dư vào 100 g dung dịch H2SO4 20% thì thể tích khí H2 (đktc) thoát ra là
A. 4,57 lít. B. 54,35 lít.
C. 49,78 lít. D. 57,35 lít.
Phương pháp giải
Tính số mol hiđro theo axit và nước.
Hướng dẫn giải
Trong 100g dung dịch H2SO4 có:
\(\left\{ \begin{gathered}
20g{H_2}S{O_4} \hfill \\
80g{H_2}O \hfill \\
\end{gathered} \right.\)
\(\begin{gathered}
{H_2}S{O_4} \to {H_2} \hfill \\
98g\,\,\,\,\,\,\,\,\,\,\,\,\,\,22,4 \hfill \\
20g\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{V_1} \hfill \\
\end{gathered} \)
\({V_1} = \frac{{22,4.20}}{{98}} = 4,57(l)\)
\(\begin{gathered}
{H_2}O \to \frac{1}{2}{H_2} \hfill \\
18g\,\,\,\,\,\,\,\,\,\,\,11,2\,lit \hfill \\
80g\,\,\,\,\,\,\,\,\,\,\,\,{V_2} \hfill \\
\end{gathered} \)
\({V_2} = \frac{{11,2.80}}{{18}} = 49,78\)
\(V = {V_1} + {V_2} = 54,35\)
Chọn B.
7. Giải bài 25.7 trang 55 SBT Hóa học 12
Điện phân nóng chảy muối clorua của một kim loại kiềm thu được 0,896 lít khí (đktc) ở anot và 1,84 g kim loại ở catot. Công thức hoá học của muối là
A. LiCl. B. NaCl.
C. KCl. D. RbCl.
Phương pháp giải
- Áp dụng định luật bảo toàn e
- Lập phương trình liên quan đến và hóa trị
=> Kim loại cần tìm
Hướng dẫn giải
Catot: Mn+ + ne → M
Anot: 2Cl- → Cl2 + 2e
nCl2 = 0,04 mol
ne cho =0,08 = ne nhận
nkim loại = 0,08/n = 1,84/M
=> M= 23n
n nhận giá trị 1; 2; 3
=> M= 23 (kim loại Na)
=> Chọn B.
8. Giải bài 25.8 trang 55 SBT Hóa học 12
Cho 1,36 gam hỗn hợp 2 kim loại kiềm kế tiếp nhau trong nhóm IA tác dụng hết với nước thu được 0,56 lít khí H2 (đktc). Đó là 2 kim loại nào sau đây ?
A. Na, K. B. Rb, Cs.
C. K, Rb. D. Li, Na.
Phương pháp giải
Gọi kim loại trung bình
- Viết phương trình hóa học
- Tính số mol kim loại trung bình theo số mol H2
- Suy ra M trung bình → đáp án cần chọn.
Hướng dẫn giải
Gọi công thức của 2 kim loại là
Ta có:
\(\overline {2M} + {H_2}O \to 2\overline M OH + {H_2}\)
\({n_{\overline M }} = 0,05mol\)
\(\overline M = \frac{{1,36}}{{0,05}} = 27,1\)
Suy ra 2 kim loại Na và K.
Chọn A.
9. Giải bài 25.9 trang 55 SBT Hóa học 12
Cho a mol CO2 vào dung dịch chứa b mol NaOH, thu được dung dịch X. Dung dịch X vừa tác dụng được với HCl vừa tác dụng được với KOH. Quan hệ giữa a và b là
A. a > b. B. b > 2a
C. a = b. D. b < 2a.
Phương pháp giải
Lập tỉ lệ: \(\frac{{{n_{O{H^ - }}}}}{{{n_{C{O_2}}}}} = T\)
- 1 thu được muối −
- 1 < T < 2 thu được đồng thời 2 muối − và 2-
- 2 thu được muối 2−
Hướng dẫn giải
Dung dịch X vừa tác dụng được với HCl vừa tác dụng được với KOH
=> Dung dịch X chứa muối −
1 hoặc 1 < T < 2
T < 2
=> b<2a
=> Chọn D.
10. Giải bài 25.10 trang 55 SBT Hóa học 12
Cho từ từ dung dịch chứa a mol HCl vào dung dịch chứa b mol Na2CO3 đồng thời khuấy đều, thu được khí X và dung dịch Y. Khi cho dư nước vôi trong vào dung dịch Y thấy xuất hiện m gam kết tủa. Biểu thức liên hệ giữa m với a và b là
A. m = 100(2b - a)
B. m = 56(2a - b).
C. m = 100(a - b).
D. m = 197(a + b).
Phương pháp giải
- Tính số mol −
- Tính số mol kết tủa
Hướng dẫn giải
Khi cho từ từ HCl vào dd Na2CO3
+CO32− → HCO3−(1)
a b b
Vì phản ứng thu được khí => (1) dư axit
+ HCO3− → CO2 + H2O(2)
a - b b
Vì sau phản ứng dung dịch tác dụng với nước vôi trong
=> HCO3− dư = 2b - a
(OH)2 + NaHCO3 → CaCO3 + NaOH + H2O
2b - a 2b - a
ttủa = 100(2b−a)
=> Chọn A.
11. Giải bài 25.11 trang 56 SBT Hóa học 12
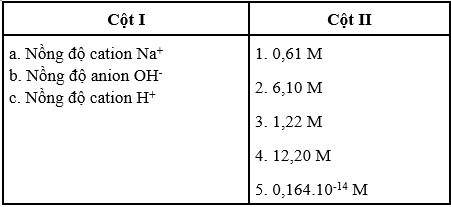
Cho dung dịch NaOH 20% (D = 1,22 g/cm3). Hãy chọn nồng độ ở cột II để ghép với ion ở cột I cho phù hợp với dung dịch trên.
Phương pháp giải
Chuyển nồng độ C% sang nồng độ CM, từ đó suy ra nồng độ của các ion.
Hướng dẫn giải
Chuyển nồng độ C% sang nồng độ CM của dung dịch NaOH được:
CM NaOH = 6,10 M
[Na+] = [OH-] = 6,10 M
\({\text{[}}{H^ + }{\text{]}} = \frac{{{{10}^{ - 14}}}}{{{\text{[}}O{H^ - }{\text{]}}}} = 0,{164.10^{ - 14}}M\)
12. Giải bài 25.12 trang 56 SBT Hóa học 12
Nhóm kim loại nào sau đây đều là kim loại nhẹ?
A. Li, Zn, Fe, Cu
B. Mg, Al, Sn, Pb
C. Na, K, Mg, Al
D. K, Ba, Ag, Zn
Phương pháp giải
Dựa vào tính chất của kim loại kiềm để xác định nhóm kim loại nhẹ trong các câu trên.
Hướng dẫn giải
Các kim loại nhẹ là Li, Na, K, Mg, Al, Zn
→ Chọn C.
13. Giải bài 25.13 trang 56 SBT Hóa học 12
Các ion và nguyên tử nào sau đây có cấu hình electron 1s22s22p6 ?
A. Na+, Mg2+, Al3+, Cl-và Ne
B. Na+, Mg2+, Al3+, Cl- và Ar
C. Na+, Mg2+, Al3+, F- và Ne
D. K+, Ca2+, Cr3+, Br- và Kr
Phương pháp giải
Dựa vào cấu hình electron của các ion và nguyên tử để kết luận ion và nguyên tử có cấu hình electron 1s22s22p6
Hướng dẫn giải
Đáp án A loại vì Cl- có cấu hình electron 1s22s22p63s23p6
Đáp án B loại vì có Cl- và Ar có cấu hình electron 1s22s22p63s23p6
Đáp án D loại vì có Ca2+, Cr3+, Br- và Kr
→ Chọn C.
14. Giải bài 25.14 trang 56 SBT Hóa học 12
Người ta thực hiện các phản ứng sau :
(1) Điện phân NaOH nóng chảy.
(2) Điện phân dung dịch NaCl có vách ngăn.
(3) Điện phân NaCl nóng chảy.
(4) Cho dung dịch NaOH tác dụng với dung dịch HCl.
(5) Cho dung dịch NaOH tác dụng với kim loại K.
Phản ứng chuyển ion Na+ thành Na là
A. (1). B. (1), (2).
C. (3), (4). D. (1), (3).
Phương pháp giải
Dựa vào phương trình phản ứng của các thí nghiệm.
Hướng dẫn giải
Thí nghiệm 1:
\(2NaOH\xrightarrow{{dpnc}}2Na + {O_2} + {H_2}\)
Thí nghiệm 2:
\(2NaCl + 2{H_2}O\xrightarrow{{dpnc}}2NaOH + C{l_2} + {H_2}\)
Thí nghiệm 3:
\(2NaCl\xrightarrow{{dpnc}}2Na + C{l_2}\)
Thí nghiệm 4:
\(NaOH + HCl \to NaCl + {H_2}O\)
Thí nghiệm 5:
\(2K + 2{H_2}O \to 2KOH + {H_2}\)
Vậy thí nghiệm (1) và (3) chuyển ion Na+ thành Na.
→ Chọn D.
15. Giải bài 25.15 trang 56 SBT Hóa học 12
Công dụng nào sau đây không phải của NaCl?
A. Điều chế kim loại Na.
B. Để điều chế Cl2, HCl, nước Giaven.
C. Khử chua cho đất.
D. Làm dịch truyền trong y tế.
Phương pháp giải
Dựa vào lý thuyết về hợp chất quan trọng của kim loại kiềm để xác định công dụng của NaCl.
Hướng dẫn giải
Công dụng của NaCl:
- Điều chế kim loại Na.
- Để điều chế Cl2, HCl, nước Giaven.
- Làm dịch truyền trong y tế.
Chọn C.
16. Giải bài 25.16 trang 57 SBT Hóa học 12
Viết phương trình hoá học của các phản ứng hoàn thành chuỗi chuyển hoá sau:
\(X\xrightarrow{1}C{l_2}\xrightarrow{2}X\xrightarrow{3}Y\xrightarrow{4}Z\xrightarrow{5}X\xrightarrow{6}NaN{O_3}\)
Biết X, Y, Z đều là hợp chất của natri.
Phương pháp giải
Dựa vào lý thuyết về hợp chất quan trọng của kim loại kiềm để xác định các chất cần tìm và viết phương trình hóa học.
Hướng dẫn giải
Theo sơ đồ ta có:
X: NaCl
Y: NaOH
Z: Na2CO3
\((1)2NaCl\xrightarrow{{dpnc}}2Na + C{l_2}\)
\((2)2Na + C{l_2} \to 2NaCl\)
\((3)2NaCl + 2{H_2}O\xrightarrow{{dpnc}}2NaOH + C{l_2} + {H_2}\)
\((4)2NaOH + C{O_2} \to N{a_2}C{O_3} + {H_2}O\)
\((5)N{a_2}C{O_3} + HCl \to 2NaCl + C{O_2} + {H_2}O\)
\((6)NaCl + AgN{O_3} \to NaN{O_3} + AgCl\)
17. Giải bài 25.17 trang 57 SBT Hóa học 12
a) Muốn pha 0,5 lít dung dịch NaOH có pH = 12,5 cần phải dùng bao nhiêu gam NaOH?
b) Để kết tủa hoàn toàn ion Cu2+ trong 200 ml dung dịch CuSO4 có nồng độ 6.10- 3M cần phải dùng bao nhiêu mililít dung dịch NaOH nói trên?
Phương pháp giải
a. Từ pH suy ra [H+] = 10-pH
→ \({\text{[}}O{H^ - }{\text{]}} = \frac{{{{10}^{ - 14}}}}{{{\text{[}}{H^ + }{\text{]}}}} = {C_{M(NaOH)}}\)
\( \to {n_{NaOH}} \to {m_{NaOH}}\)
b. \({n_{C{u^{2 + }}}} = {n_{CuS{O_4}}}\)
\(C{u^{2 + }} + 2O{H^ - } \to Cu{(OH)_2}\)
\({n_{{\text{[}}O{H^ - }{\text{]}}}} = 2{n_{C{u^{2 + }}}} = {n_{NaOH}} \to {V_{NaOH}}\)
Hướng dẫn giải
a. pH = 12,5 H+]=10−12,5→ [OH−]=10−14/10−12,5=10−1,5
Mà V = 0,5 lít =[OH−].V = 10−1,5.0,5 = 0,0158 mol
→mNaOH= 0,0158.40 = 0,632 gam.
b. \({n_{C{u^{2 + }}}} = {n_{CuS{O_4}}} = 0,{2.6.10^{ - 3}} = 1,{2.10^{ - 3}}mol\)
\(C{u^{2 + }} + 2O{H^ - } \to Cu{(OH)_2}\)
\({n_{{\text{[}}O{H^ - }{\text{]}}}} = 2{n_{C{u^{2 + }}}} = 2,{4.10^{ - 3}}mol\)
\( \to {V_{NaOH}} = \frac{{2,{{4.10}^{ - 3}}}}{{{{10}^{ - 1,5}}}} = 0,076\left( l \right)\)
18. Giải bài 25.18 trang 57 SBT Hóa học 12
Nung nóng 7,26 g hỗn hợp gồm NaHCO3 vào Na2CO3, người ta thu được 0,84 lít khí CO2 (đktc).
Hãy xác định khối lượng của mỗi chất có trong hỗn hợp trước và sau khi nung.
Phương pháp giải
- Nung hỗn hợp, chỉ có NaHCO3 bị phân hủy:
\(2NaHC{O_3}\xrightarrow{{{t^o}}}N{a_2}C{O_3} + C{O_2} + {H_2}O\)
- Theo phương trình, tính được khối lượng của NaHCO3 và Na2CO3 trước khi nung
- Sau khi nung, hỗn hợp thu được bao gồm Na2CO3 ban đầu và Na2CO3 sản phẩm của phản ứng nhiệt phân.
Hướng dẫn giải
Nung hỗn hợp, chỉ có NaHCO3 bị phân hủy:
\(2NaHC{O_3}\xrightarrow{{{t^o}}}N{a_2}C{O_3} + C{O_2} + {H_2}O\)
Theo phương trình:
nNaHCO3 = 2nCO2 = 2.0,84/22,4 = 0,075 mol
Trước khi nung: mNaHCO3 = 84.0,075 = 6,3 gam
mNa2CO3 = 7,26 - 6,3 = 0,96 gam
Sau khi nung: mNa2CO3 = 0,96 + 106.0,0375 = 4,935 gam.
Tham khảo thêm
- doc Giải bài tập SBT Hóa 12 Bài 26: Kim loại kiềm thổ và hợp chất quan trọng của kim loại kiềm thổ
- doc Giải bài tập SBT Hóa 12 Bài 27: Nhôm và hợp chất của nhôm
- doc Giải bài tập SBT Hóa 12 Bài 28: Luyện tập Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng
- doc Giải bài tập SBT Hóa 12 Bài 29: Luyện tập Tính chất của nhôm và hợp chất của nhôm