Giải bài tập SBT Hóa 12 Bài 29: Luyện tập Tính chất của nhôm và hợp chất của nhôm
Hướng dẫn Giải bài tập Sách bài tập Hóa học 12 Bài 29 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về tính chất của nhôm và hợp chất của nhôm. Mời các em cùng theo dõi.
Mục lục nội dung
1. Giải bài 29.1 trang 68 SBT Hóa học 12
2. Giải bài 29.2 trang 68 SBT Hóa học 12
3. Giải bài 29.3 trang 68 SBT Hóa học 12
4. Giải bài 29.4 trang 69 SBT Hóa học 12
5. Giải bài 29.5 trang 69 SBT Hóa học 12
6. Giải bài 29.6 trang 69 SBT Hóa học 12
7. Giải bài 29.7 trang 69 SBT Hóa học 12
8. Giải bài 29.8 trang 69 SBT Hóa học 12
9. Giải bài 29.9 trang 69 SBT Hóa học 12
10. Giải bài 29.10 trang 69 SBT Hóa học 12
11. Giải bài 29.11 trang 70 SBT Hóa học 12
12. Giải bài 29.12 trang 70 SBT Hóa học 12

1. Giải bài 29.1 trang 68 SBT Hóa học 12
Phát biểu nào sau đây đúng khi nói về nhôm oxit ?
A. Al2O3 được sinh ra khi nhiệt phân muối Al(NO3)3.
B. Al2O3 bị khử bởi CO ở nhiệt độ cao.
C. Al2O3 tan được trong dung dịch NH3.
D. Al2O3 là oxit không tạo muối.
Phương pháp giải
Dựa vào lý thuyết về nhôm và hợp chất để chọn đáp án đúng.
Hướng dẫn giải
A. đúng
B. sai do CO chỉ khử được oxit của các kim loại đứng sau Al trong dãy điện hóa
C. sai do NH3 có tính bazơ yếu nên không hòa tan được Al2O3
D. sai do Al2O3 là oxit lưỡng tính, có tạo muối
Chọn A.
2. Giải bài 29.2 trang 68 SBT Hóa học 12
Có các dung dịch : KNO3, Cu(NO3)2, FeCl3, AlCl3, NH4Cl. Chỉ dùng hoá chất nào sau đây có thể nhận biết được các dung dịch trên ?
A. Dung dịch NaOH dư.
B. Dung dịch AgNO3.
C. Dung dịch Na2SO4.
D. Dung dịch HCl.
Phương pháp giải
Dùng dung dịch NaOH để nhận biết các dung dịch KNO3, Cu(NO3)2, FeCl3, AlCl3, NH4Cl.
Hướng dẫn giải
Cho từ từ dung dịch NaOH đến dư vào các dung dịch trên:
- Tạo ra kết tủa màu xanh là Cu(NO3)2
- Tạo ra kết tủa nâu đỏ là FeCl3
- Tạo ra kết tủa trắng, tan trong NaOH dư là AlCl3
- Có khí mùi khai (NH3) thoát ra là NH4Cl:
Cl +NaOH → NaCl + NH3↑ + H2O
- Không có hiện tượng gì là KNO3
Chọn A.
3. Giải bài 29.3 trang 68 SBT Hóa học 12
Cho m gam bột Al tác dụng hết với dung dịch O3 dư chỉ thu được 8,96 lít hỗn hợp khí X gồm NO và N2O (đktc) có tỉ lệ mol là 1 : 3. Giá trị của m là
A. 24,3. B. 42,3.
C. 25,3. D. 25,7.
Phương pháp giải
- Bước 1: Tính số mol mỗi khí trong hỗn hợp X
- Bước 2: Áp dụng bảo toàn electron tìm số mol Al
- Bước 3: Từ đó tính khối lượng Al
Hướng dẫn giải
\(Al + 4HN{O_3} \to Al{(N{O_3})_3} + NO + 2{H_2}O(1)\)
\(8Al + 30HN{O_3} \to 8Al{(N{O_3})_3} + 3{N_2}O + 15{H_2}O(2)\)
\({n_x} = \frac{{8,96}}{{22,4}} = 0,4(mol);{n_{NO}} = 0,1(mol)\)
\({n_{{N_2}O}} = 0,3(mol)\)
\({n_{Al(1)}} = {n_{NO}} = 0,1mol;{n_{Al(2)}} = \frac{{0,3.8}}{3} = 0,8mol\)
\({m_{Al}} = 0,9.27 = 24,3(g)\)
Chọn A.
4. Giải bài 29.4 trang 69 SBT Hóa học 12
Trộn 24 g Fe2O3 với 10,8 g Al rồi nung ở nhiệt độ cao (không có không khí). Hỗn hợp thu được sau phản ứng đem hoà tan vào dung dịch NaOH dư thu được 5,376 lít khí (đktc). Hiệu suất của phản ứng nhiệt nhôm là
A.12,5%. B. 60%.
C. 80%. D. 90%.
Phương pháp giải
- Bước 1: So sánh tỷ lệ số mol của Al và Fe2O3, kết luận hiệu suất tính theo chất nào
- Bước 2: Viết phương trình phản ứng, tính số mol Al dư theo số mol H2, suy ra số mol Al và Fe2O3 phản ứng
- Bước 3: Suy ra hiệu suất phản ứng.
Hướng dẫn giải
\({n_{F{e_2}{O_3}}} = \frac{{24}}{{160}} = 0,15mol;{n_{Al}} = \frac{{10,8}}{{27}} = 0,4mol;{n_{{H_2}}} = 0,24mol\)
\(2Al + F{e_2}{O_3}\xrightarrow{{{t^o}}}A{l_2}{O_3} + 2Fe\)
\(\frac{{{n_{Al}}}}{2} > \frac{{{n_{F{e_2}{O_3}}}}}{1}\) , suy ra Al dư, hiệu suất tính theo Fe2O3
\(2Al + 2NaOH + 2{H_2}O \to 2NaAl{O_2} + 3{H_2}\)
\({n_{Al(du)}} = \frac{2}{3}{n_{{H_2}}} = 0,16mol \to {n_{Al(pu)}} = 0,4 - 0,16 = 0,24mol\)
\({n_{F{e_2}{O_3}(pu)}} = \frac{1}{2}{n_{Al(pu)}} = 0,12mo\)
\(H = \frac{{0,12}}{{0,15}}.100\% = 80\% \)
Chọn C.
5. Giải bài 29.5 trang 69 SBT Hóa học 12
Cho nhôm tác dụng với dung dịch chứa NaN03 và NaOH thấy nhôm tan và giải phóng NH3. Trong phương trình hoá học của phản ứng trên hệ số nguyên tối giản của H2O bằng
A. 3. B. 2.
C. 5. D. 7.
Phương pháp giải
Viết phương trình ion thu gọn của phản ứng để xác định hệ số nguyên tối giản của H2O.
Hướng dẫn giải
8Al + 3NO3- + 5OH- +2H2O → 8AlO2- + 3NH3
Chọn B.
6. Giải bài 29.6 trang 69 SBT Hóa học 12
Xác định những chất cần lấy cho sơ đồ phản ứng sau :
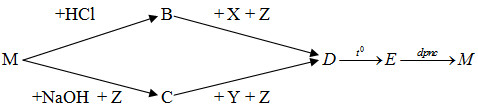
Phương pháp giải
Dựa vào lý thuyết về nhôm và hợp chất của nhôm, đồng thời dựa vào những chất đã cho để suy ra những chất còn lại.
Hướng dẫn giải
M: Al
B : AlCl3
Z : H2O
X : NH3
D : Al(OH)3
C: NaAlO2
E : Al2O3
7. Giải bài 29.7 trang 69 SBT Hóa học 12
Có các chất : NH3, CO2, HCl, KOH, Na2CO3. Có thể dùng những chất nào để kết tủa Al(OH)3 từ dung dịch :
a) Nhôm clorua?
b) Natri aluminat?
Phương pháp giải
Cần nắm rõ tính chất hóa học của nhôm clorua và natri aluminat để chọn những chất thích hợp có thể tạo kết tủa Al(OH)3
Hướng dẫn giải
a) Các chất có thể dùng là NH3, KOH, Na2CO3 :
AlCl3 + 3NH3 + 3H2O → Al(OH)3 ↓ + 3NH4Cl
AlCl3 + 3KOH (vừa đủ) → Al(OH)3↓ + 3KCl
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + 3CO2↑+ 6NaCl
b) Các chất có thể dùng là CO2, HCl :
NaAlO2 + CO2 + 2H2O → Al(OH)3↓+ NaHCO3
NaAlO2 + HCl (vùa đủ) + H2O →Al(OH)3↓+ NaCl.
8. Giải bài 29.8 trang 69 SBT Hóa học 12
Từ Al2O3 và các dung dịch KOH, H2SO4, viết phương trình hoá học của các phản ứng dùng để điều chế phèn chua.
Phương pháp giải
Cần nắm rõ cách điều chế phèn chua, đồng thời dựa vào những chất có sẵn để viết phương trình hóa học.
Hướng dẫn giải
2KOH + H2SO4 → K2SO4 + 2H2O
Cô cạn dung dịch được tinh thể K2SO4 khan
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Cô cạn dung dịch thu được tinh thể Al2(SO4)3.18H2O
- Hoà tan 1 mol K2SO4 vào nước cất.
- Hoà tan 1 mol Al2(SO4)3.18H2O vào cốc nước cất khác.
- Đun nóng cả hai dung dịch, trộn 2 dung dịch với nhau rồi khuấy mạnh, sau đó để nguội, một thời gian thấy dung dịch bị vẩn đục, các tinh thể K2SO4.Al2(SO4)3.24H2O sẽ tách ra.
9. Giải bài 29.9 trang 69 SBT Hóa học 12
Dựa trên cơ sở hoá học nào để điều chế nhôm oxit từ quặng boxit ? Viết phương trình hoá học của các phản ứng xảy ra.
Phương pháp giải
Dựa vào lý thuyết về điều chế nhôm oxi để nêu lên cơ sở hoá học điều chế nhôm oxit từ quặng boxit.
Hướng dẫn giải
Quặng boxit gồm chủ yếu là Al2O3, có lẫn các tạp chất là Fe2O3 và SiO2 (cát). Việc tách Al2O3 nguyên chất ra khỏi các tạp chất dựa vào tính lưỡng tính của Al2O3.
- Nghiền nhỏ quặng rồi cho vào dung dịch NaOH loãng, nóng :
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Lọc bỏ Fe2O3 và SiO2 không tan.
- Sục khí CO2 dư vào dung dịch NaAlO2 :
NaAlO2 + CO2 + 2H2O → Al(OH)3↓ + NaHCO3
Lọc lấy Al(OH)3 rồi nhiệt phân :
\(Al{(OH)_3}\xrightarrow{{{t^o}}}A{l_2}{O_3} + 3{H_2}O\)
10. Giải bài 29.10 trang 69 SBT Hóa học 12
Criolit được điều chế theo phản ứng sau :
Al2O3 (rắn) + HF (dd) + NaOH (dd) → Na3AlF6 (rắn) + H2O
Tính khối lượng mỗi chất ban đầu để sản xuất 1 kg criolit. Coi hiệu suất phản ứng đạt 100%.
Phương pháp giải
- Viết phương trình hóa học.
- Tính theo phương trình phản ứng.
Hướng dẫn giải
Al2O3 + 12HF + 6NaOH → 2Na3AlF6 + 9H2O
Ta có: 102 12.20 6. 40 2.210
0,248(kg)←0,5714(kg)←0,5714(kg)←1(kg)
→ 242,8 g A12O3 ; 571,4 g HF ; 571,4 g NaOH.
11. Giải bài 29.11 trang 70 SBT Hóa học 12
Cho 2,16 gam Al vào dung dịch HNO3 loãng, lạnh (vừa đủ) thì thu được dung dịch X và không thấy khí thoát ra. Thêm dung dịch NaOH vào dung dịch X đến khi kết tủa tạo ra rồi vừa tan hết. Tính số mol NaOH đã dùng.
Phương pháp giải
- Áp dụng bảo toàn electron để tính số mol NH4NO3
- Vậy NaOH phản ứng với Al(NO3)3 và NH4NO3 trong dung dịch X.
- Viết phương trình phản ứng và tính theo phương trình phản ứng suy ra số mol NaOH.
Hướng dẫn giải
Không có khí thoát ra ⟹ sản phẩm khử là : NH4NO3.
Bảo toàn điện tích ta có: nAl.3 = nNH4NO3.8 ⟹ nNH4 NO3= 0,03 (mol).
Dung dịch gồm : Al(NO3)3 : 0,08 mol và NH4NO3 : 0,03 mol
NH4NO3 + NaOH → NaNO3 + NH3↑ + H2O.
Al(NO3)3 + 3NaOH → Al(OH)3↓ + 3NaNO3.
NaOH + Al(OH)3 → NaAlO2 + 2H2O.
nNaOH = nNH4NO3 + 3.nAl(NO3)3 + n Al(OH)3 = + 3.0,08 + 0,08 = 0,35 (mol).
12. Giải bài 29.12 trang 70 SBT Hóa học 12
Lấy 26,8 gam hỗn hợp bột X gồm Al và Fe2O3, tiến hành phản ứng nhiệt nhôm cho tới khi phản ứng xảy ra hoàn toàn (giả sử chỉ xảy ra phản ứng khử Fe2O3 thành Fe). Hỗn hợp sản phẩm sau phản ứng cho tác dụng với lượng dư dung dịch HCl được 11,2 lít H2 (đktc). Xác định khối lượng của Al trong hỗn hợp bột X.
Phương pháp giải
- Bước 1: Viết phương trình phản ứng nhiệt nhôm
- Bước 2: Xét 2 trường hợp
+ TH1: Al hết, Fe2O3 dư
Tính số mol Fe theo số mol H2, suy ra khối lượng Fe, xét tính thỏa mãn của trường hợp này
+ TH2: Al dư, Fe2O3 hết
- Bước 3: Gọi số mol của Al và Fe2O3 ban đầu là a, b mol
Lập phương trình tổng khối lượng hỗn hợp ban đầu
Lập phương trình số mol H2
- Bước 4: Giải hệ phương trình, suy ra số mol và khối lượng Al.
Hướng dẫn giải
PTHH của phản ứng nhiệt nhôm :
\(2Al + F{e_2}{O_3}\xrightarrow{{{t^o}}}A{l_2}{O_3} + 2Fe\)
Trường hợp Al hết:
\(Fe\xrightarrow{{HCl}}{H_2}\)
⟹ nFe = nH2 = 0,5 (mol) ⟹ mFe = 0,5.56 = 28 (g) > 26 (g)
(Loại vì mâu thuẫn định luật bảo toàn khối lượng).
Trường hợp Al dư :
\(Fe\xrightarrow{{HCl}}{H_2};Al\xrightarrow{{HCl}}\frac{3}{2}{H_2}\)
Gọi a, b lần lượt là số mol của Al và Fe203 ban đầu.
27a + 160b = 26,8 → a = 0,4 (mol)
2b + (a - 2b). 1,5 = 0,5 b = 0,1 (mol)
Vậy mAl = 27.0,4 = 10,8 (g).
13. Giải bài 29.13 trang 70 SBT Hóa học 12
Nung 9,66 gam hỗn hợp bột X gồm Al và một oxit sắt trong điều kiện không có không khí, khi phản ứng nhiệt nhôm xảy ra hoàn toàn (giả sử chí xảy ra phản ứng khử oxit sắt thành sắt) thu được hỗn hợp sản phẩm Y. Chia Y làm 2 phần đều nhau :
- Phần 1 : Cho tác dụng với dung dịch NaOH dư thấy thoát ra 0,336 lít H2 (đktc).
- Phần 2 : Cho tác dụng với dung dịch HCl dư được 1,344 lít H2 (đktc). Xác định công thức oxit sắt trong hỗn hợp bột X.
Phương pháp giải
- Từ số mol H2 trong phản ứng mỗi phần, suy ra số mol Fe và Al dư
- Suy ra số mol Al ban đầu trong hỗn hợp X.
- Lập biểu thức khối lượng hỗn hợp ban đầu, suy ra công thức oxit sắt
Hướng dẫn giải
- Phần 1 : Tác dụng với dung dịch NaOH → H2 nên Al dư.
\(Al\xrightarrow{{NaOH}}\frac{3}{2}{H_2}\)
Phần 2 : Tác dụng với dung dịch HCl
\(Fe\xrightarrow{{HCl}}{H_2};Al\xrightarrow{{HCl}}\frac{3}{2}{H_2}\)
Từ thể tích H2 ta dễ dàng tính được :
nFe = 0,045 (mol) và nAl(dư) = 0,01 (mol).
Phản ứng nhiệt nhôm : 2yAl + 3FexOy ⟶ yAl203 + 3xFe
0,045 mol
⟹ nAl (ban đầu) = (3x + 0,01 = 0,03y/x + 0,01 mol
\({m_{hh}} = 27.(\frac{{0,03y}}{x} + 0,01) + 0,045.(56x + 16y) = \frac{{9,66}}{2}g\)
\( \Rightarrow \frac{x}{y} = \frac{3}{4}\)
Vây oxit sắt là Fe3O4
14. Giải bài 29.14 trang 70 SBT Hóa học 12
Cho 18 gam hỗn hợp bột Al, Al2O3 và một kim loại R hoá trị II không đổi.
- Nếu cho hỗn hợp tác dụng với dung dịch H2SO4 loãng (dư) thấy thoát ra 8,96 lít H2 (đktc).
- Nếu cho hỗn hợp tác dụng với dung dịch NaOH 2M thấy thoát ra 6,72 lít H2 (đktc) và lượng NaOH tối đa cho phản ứng là 200 ml, ngoài ra còn một phần chất rắn không tan.
Xác định kim loại R và phần trăm khối lượng Al203 trong hỗn hợp.
Phương pháp giải
- Bước 1: Gọi số mol của Al, Al2O3 và R lần lượt là a, b, c mol
- Bước 2: Lập phương trình số mol H2 khi hỗn hợp tác dụng với dung dịch H2SO4
Lập phương trình số mol NaOH
Lập phương trình số mol H2 khi hỗn hợp tác dụng với dung dịch NaOH
- Bước 3: Giải hệ phương trình, suy ra số mol của Al, Al2O3 và R.
- Bước 4: Lập biểu thức tính khối lượng hỗn hợp, suy ra nguyên tử khối của R
Kết luận kim loại R.
Hướng dẫn giải
Gọi a, b, c lần lượt là số mol của Al, Al203 và R.
Do thể tích 2 khí thoát ra khi tác dụng với dung dịch H2S04 loãng và NaOH khác nhau nên R đứng trước H2 (trong dãy điện hoá) nhưng không tác dụng với NaOH.
Khi tác dụng với dung dịch H2S04 loãng :
\(Al\xrightarrow{{{H_2}S{O_4}}}\frac{3}{2}{H_2};R\xrightarrow{{{H_2}S{O_4}}}{H_2}\)
⟹ 1,5a + c = 0,4 (1)
Khi tác dụng với dung dịch NaOH :
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Al203 + 2NaOH → 2NaAl02 + H20
nH2 = 1,5a = 0,3 (2)
nNaOH =a + 2b = 0,4
Từ (1) và (2) → a = 0,2 mol ; b = 0,1 mol và c = 0,1 mol.
Vậy mhh = 27.0,2 + 102.0,1 + R.0,1 = 18 ⟹ R = 24 (Mg).
⟹ % Al2O3= (.100 = 56,67%
Tham khảo thêm
- doc Giải bài tập SBT Hóa 12 Bài 25: Kim loại kiềm và hợp chất quan trọng của kim loại kiềm
- doc Giải bài tập SBT Hóa 12 Bài 26: Kim loại kiềm thổ và hợp chất quan trọng của kim loại kiềm thổ
- doc Giải bài tập SBT Hóa 12 Bài 27: Nhôm và hợp chất của nhôm
- doc Giải bài tập SBT Hóa 12 Bài 28: Luyện tập Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng
