Giải bài tập SBT Hóa 12 Bài 35: Đồng và hợp chất của đồng
Hướng dẫn Giải bài tập Sách bài tập Hóa học 12 Bài 35 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về đồng và hợp chất của đồng. Mời các em cùng theo dõi.
Mục lục nội dung
1. Giải bài 35.1 trang 83 SBT Hóa học 12
2. Giải bài 35.2 trang 83 SBT Hóa học 12
3. Giải bài 35.3 trang 84 SBT Hóa học 12
4. Giải bài 35.4 trang 84 SBT Hóa học 12
5. Giải bài 35.5 trang 84 SBT Hóa học 12
6. Giải bài 35.6 trang 84 SBT Hóa học 12
7. Giải bài 35.7 trang 84 SBT Hóa học 12
8. Giải bài 35.8 trang 85 SBT Hóa học 12
9. Giải bài 35.9 trang 85 SBT Hóa học 12
10. Giải bài 35.10 trang 85 SBT Hóa học 12
11. Giải bài 35.11 trang 85 SBT Hóa học 12
12. Giải bài 35.12 trang 85 SBT Hóa học 12
13. Giải bài 35.13 trang 85 SBT Hóa học 12
14. Giải bài 35.14 trang 86 SBT Hóa học 12
15. Giải bài 35.15 trang 86 SBT Hóa học 12
16. Giải bài 35.16 trang 86 SBT Hóa học 12
17. Giải bài 35.17 trang 86 SBT Hóa học 12
18. Giải bài 35.18 trang 86 SBT Hóa học 12
19. Giải bài 35.19 trang 87 SBT Hóa học 12

1. Giải bài 35.1 trang 83 SBT Hóa học 12
Trong phòng thí nghiệm, để điều chế CuSO4 người ta cho Cu tác dụng với dung dịch nào sau đây
A. H2SO4 đậm đặc B. H2SO4 loãng.
C. Fe2(S04)3 loãng. D. FeSO4 loãng.
Phương pháp giải
Xem lại lí thuyết về đồng và hợp chất của đồng để chọn đáp án phù hợp.
Hướng dẫn giải
Trong phòng thí nghiệm, để điều chế CuSO4 người ta cho Cu tác dụng với dung dịch H2SO4 đậm đặc
→ Chọn A.
2. Giải bài 35.2 trang 83 SBT Hóa học 12
Có các dung dịch : HCl, HNO3, NaOH, AgNO3, NaNO3. Chỉ dùng thêm chất nào sau đây để nhận biết các dung dịch trên
A. Cu.
B.Dung dịch Al2(SO4)3.
C. Dung dịch BaCl2.
D. Dung dịch Ca(OH)2.
Phương pháp giải
Với các dung dịch đã cho, khi chỉ dùng thêm 1 chất để nhận biết các dung dịch trên có thể chọn Cu làm thuốc thử.
Hướng dẫn giải
Cho Cu vào các dung dịch trên:
- Không có phản ứng là: HCl, NaOH, NaNO3.
- Có phản ứng là:
3Cu + 8HNO3 ⟶ 3Cu(NO3)2 +2NO↑ + 4H2O
Khí NO hóa nâu trong không khí:
2NO + O2 ⟶ 2NO2
Cu + 2AgNO3 ⟶ Cu(NO3)2 +2Ag↓
- Lấy dung dịch AgNO3 để nhận ra dung dịch HCl (Kết tủa AgCl trắng), nhận ra dung dịch NaOH (Kết tủa Ag2O đen)
- Còn lại là dung dịch NaNO3.
→ Chọn A.
3. Giải bài 35.3 trang 84 SBT Hóa học 12
Ba hỗn hợp kim loại (1) Cu-Ag, (2) Cu- Al, (3) Cu -Mg
Dung dịch của cặp chất nào sau đây để nhận biết các hỗn hợp trên
A. HCl và AgNO3 B. HCl và Al(NO3)3
C. HCl và Mg(NO3)2 D. HCl và NaOH
Phương pháp giải
Với 3 hỗn hợp kim loại đã cho, để nhận biết ta có thể chọn thuốc thử là HCl và NaOH, viết phương trình hóa học để minh họa.
Hướng dẫn giải
- Cho từng hỗn hợp tác dụng với dung dịch HCl nhận ra hỗn hợp Cu – Ag không tác dụng.
- Hỗn hợp (2) tạo ta dung dịch AlCl3 và hỗn hợp (3) tạo ra dung dịch MgCl2 phân biệt bằng dung dịch NaOH:
AlCl3 + 3NaOH ⟶ Al(OH)3↓ +3NaCl
tan trong NaOH dư
MgCl2 + 2NaOH ⟶ Mg(OH)2↓ + 2NaCl
không tan trong NaOH dư
→ Chọn D.
4. Giải bài 35.4 trang 84 SBT Hóa học 12
Cho V lít khí H2 (đktc) đi qua bột CuO (dư) đun nóng, thu được 32 g Cu. Nếu cho V lít H2 (đktc) đi qua bột FeO (dư) đun nóng thì khối lượng Fe thu được (Giả sử hiệu suất của các phản ứng là 100%) là
A. 24 g. B. 26 g.
C. 28 g. D. 30 g.
Phương pháp giải
- Trong phản ứng với CuO, tìm được số mol H2
- Trong phản ứng với FeO, tính được số mol Fe theo số mol H2
- Tính khối lượng Fe thu được
Hướng dẫn giải
\({n_{{H_2}}} = {n_{Cu}} = {n_{Fe}} = \frac{{32}}{{64}} = 0,5mol\)
\({m_{Fe}} = 56.0,5 = 28(g)\)
Chọn C.
5. Giải bài 35.5 trang 84 SBT Hóa học 12
Cho hỗn hợp gồm 0,1 mol Ag2O và 0,2 mol Cu tác dụng hết với dung dịch HNO3 loãng, dư. Cô cạn dung dịch thu được sau phản ứng được hỗn hợp muối khan A. Nung A đến khối lượng không đổi thu được chất rắn B có khối lượng là
A. 26,8 g. B. 13,4 g.
C. 37,6 g. D. 34,4 g.
Phương pháp giải
- Viết sơ đồ phản ứng, tính theo sơ đồ phản ứng tính được số mol chất rắn B
- Suy ra khối lượng của b.
Hướng dẫn giải
\(A{g_2}O \to 2AgN{O_3} \to 2Ag\)
\({m_{Ag}} = 108.0,2 = 21,6(g)\)
\(Cu \to Cu{(N{O_3})_2} \to CuO\)
\({m_{Cu}} = 80.0,2 = 16(g)\)
Chọn C.
6. Giải bài 35.6 trang 84 SBT Hóa học 12
Cho 19,2 g Cu tác dụng hết với dung dịch HNO3 loãng, dư. Khí NO thu được đem oxi hoá thành NO2 rồi sục vào nước cùng với dòng khí 02 để chuyển hết thành HNO3. Thể tích khí O2 (đktc) đã tham gia vào quá trình trên là
A. 2,24 lít. B. 3,36 lít.
C. 4,48 lít. D. 6,72 lít.
Phương pháp giải
Viết phương trình phản ứng và tính số mol O2 theo phương trình phản ứng.
Hướng dẫn giải
\(3Cu + HN{O_3} \to 3Cu{(N{O_3})_2} + 2NO + 4{H_2}O\)
\(2NO + {O_2} \to 2N{O_2}\)
\(4N{O_2} + {O_2} + 2{H_2}O \to 4HN{O_3}\)
\({V_{{O_2}}} = (0,1 + 0,05).22,4 = 3,36(l)\)
Chọn B.
7. Giải bài 35.7 trang 84 SBT Hóa học 12
Cho sơ đồ chuyển hoá quặng đồng thành đồng:
\(CuFe{S_2}\xrightarrow{{ + {O_2},{t^o}}}X\xrightarrow{{ + {O_2},{t^o}}}Y\xrightarrow{{ + X,{t^o}}}Cu\)
Hai chất X, Y lần lượt là
A. Cu2O, CuO. B. CuS, CuO.
C. Cu2S, CuO. D. Cu2S, Cu2O.
Phương pháp giải
Cần viết sơ đồ phản ứng và kết luận các sản phẩm còn thiếu để chọn đáp án đúng.
Hướng dẫn giải
\(CuFe{S_2}\xrightarrow{{ + {O_2},{t^o}}}C{u_2}S\xrightarrow{{ + {O_2},{t^o}}}C{u_2}O\xrightarrow{{ + C{u_2}S,{t^o}}}Cu\)
Vậy X là Cu2S, Y là Cu2O
Chọn D.
8. Giải bài 35.8 trang 85 SBT Hóa học 12
Cho hỗn hợp Fe, Cu phản ứng với dung dịch HNO3 loãng. Sau khi phản ứng hoàn toàn, thu được dung dịch chỉ chứa một chất tan và kim loại dư. Chất tan đó là
A. Cu(NO3)2. B. HNO3.
C. Fe(NO3)2. D. Fe(NO3)3.
Phương pháp giải
Vì Fe có tính khử mạnh hơn Cu nên Fe phản ứng trước, và sau phản ứng còn kim loại dư nên thu được muối sắt (II).
Hướng dẫn giải
Chất tan thu được là Fe(NO3)2
→ Chọn C.
9. Giải bài 35.9 trang 85 SBT Hóa học 12
Cho các phản ứng:
\((1)C{u_2}O + C{u_2}S\xrightarrow{{{t^o}}}\)
\((2)Cu{(N{O_3})_2}\xrightarrow{{{t^o}}}\)
\((3)CuO + CO\xrightarrow{{{t^o}}}\)
\((4)CuO + N{H_3}\xrightarrow{{{t^o}}}\)
Số phản ứng tạo ra kim loại Cu là
A. 2. B. 3.
C. 1 D. 4
Phương pháp giải
Dựa vào lý thuyết về Cu và hợp chất của Cu để hoàn thành các phương trình hóa học trên.
Hướng dẫn giải
Các phản ứng tạo ra Cu là 1, 3, 4
\((1)2C{u_2}O + C{u_2}S\xrightarrow{{{t^o}}}6Cu + S{O_2}\)
\((2)Cu{(N{O_3})_2}\xrightarrow{{{t^o}}}2CuO + 4N{O_2} + {O_2}\)
\((3)CuO + CO\xrightarrow{{{t^o}}}Cu + C{O_2}\)
\((4)CuO + N{H_3}\xrightarrow{{{t^o}}}3Cu + {N_2} + 3{H_2}O\)
Chọn B.
10. Giải bài 35.10 trang 85 SBT Hóa học 12
Nhận định nào sau đây không đúng ?
A. Cu là kim loại chuyển tiếp, thuộc nhóm IB, chu kì 4, ô số 29 trong bảng tuần hoàn.
B. Cu là nguyên tố s, có cấu hình electron : [Ar]3d104s1.
C. Cấu hình electron của ion Cu+ là [Ar]3d10 và Cu2+ là [Ar]3d9.
D. So với kim loại nhóm IA, liên kết trong đơn chất đồng vững chắc hơn.
Phương pháp giải
Dựa vào lý thuyết về tính chất của Cu và hợp chất của Cu để chọn đáp án phù hợp.
Hướng dẫn giải
Cu là nguyên tố d, có cấu hình electron [Ar]3d104s1
→Chọn B.
11. Giải bài 35.11 trang 85 SBT Hóa học 12
Khi Cu phản ứng với dung dịch chứa H2SO4 loãng và NaNO3, vai trò của NaNO3 trong phản ứng là
A. chất xúc tác. B. chất oxi hoá.
C. chất khử. D. môi trường.
Phương pháp giải
Để chọn đáp án phù hợp cần viết phương trình ion, dựa vào phương trình đã viết để xác định vai trò của NaNO3 trong phản ứng.
Hướng dẫn giải
\(3Cu + 8{H^ + } + 2N{O_3}^ - \to 3C{u^{2 + }} + 2NO + 4{H_2}O\)
Nguyên tố N trong NaNO3 giảm số oxi hóa từ +5 xuống +2 trong NO nên NaNO3 là chất oxi hóa
→ Chọn B.
12. Giải bài 35.12 trang 85 SBT Hóa học 12
Trong không khí ẩm (có chứa CO2), kim loại Cu thường bị bao phủ bởi một lớp màng màu xanh là
A. CuCO3 B. CuSO4.
C. Cu(OH)2. D. CuCO3.Cu(OH)2
Phương pháp giải
Để chọn đáp án đúng cần ghi nhớ: Trong không khí ẩm (có chứa CO2), kim loại Cu thường bị bao phủ bởi một lớp màng màu xanh là CuCO3.Cu(OH)2 (gỉ đồng).
Hướng dẫn giải
Trong không khí ẩm (có chứa CO2), kim loại Cu thường bị bao phủ bởi một lớp màng màu xanh là CuCO3.Cu(OH)2 (gỉ đồng)
→ Chọn D.
13. Giải bài 35.13 trang 85 SBT Hóa học 12
Có 4 dung dịch muối riêng biệt : CuCl2, ZnCl2, FeCl3, AlCl3. Nếu thêm dung dịch KOH dư rồi thêm tiếp dung dịch NH3 dư vào 4 dung dịch trên thì số chất kết tủa thu được là '
A. 1. B. 2.
C.3 D. 4.
Phương pháp giải
Al(OH)3 và Zn(OH)2 tan trong dung dịch KOH dư
Cu2+ và Zn2+ có khả năng tạo phức với NH3
Hướng dẫn giải
CuCl2 + 2KOH Cu(OH)2 + 2KCl
ZnCl2 + 2KOH Zn(OH)2 + 2KCl
Zn(OH)2 + 2KOH K2ZnO2 + 2H2O
FeCl3 + 3KOH Fe(OH)3 + 3KCl
AlCl3 + 3KOH Al(OH)3 + 3KCl
Al(OH)3 + KOH KAlO2 + 2H2O
Cu(OH)2 + 4NH3 [Cu(NH3)4](OH)2
Vậy sau phản ứng chỉ thu được kết tủa Fe(OH)3
→ Chọn A.
14. Giải bài 35.14 trang 86 SBT Hóa học 12
Cho sơ đồ sau :
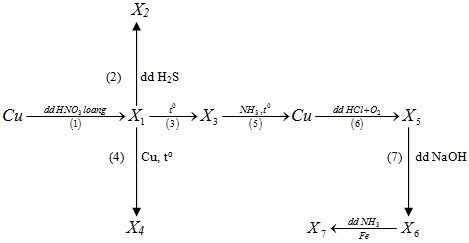
Biết các chất từ X1 đến X7 đều là các hợp chất của đồng. Trong sơ đồ trên số phản ứng oxi hoá - khử là
A. 4. B. 5.
C. 6. D.7
Phương pháp giải
Dựa vào tính chất của đồng và các hợp chất của đồng, để viết phương trình hóa học hoàn thành sơ đồ phản ứng trên.
Hướng dẫn giải
1) 3Cu + 8HNO3 loãng 3Cu(NO3)2 (X1) + 2NO + 4H2O
(2) Cu(NO3)2 + H2S CuS (X2) + 2HNO3
(3) 2Cu(NO3)2 2CuO (X3) + 4NO2 + O2
(4) CuO + Cu Cu2O
(5) 3CuO + 2NH3 3Cu + N2 + 3H2O
(6) 2Cu + 4HCl + O2 2CuCl2 + 2H2O
(7) CuCl2 + 2NaOH Cu(OH)2 + 2NaCl
(8) Cu(OH)2 + 4NH3 [Cu(NH3)4](OH)2
Fe + [Cu(NH3)4](OH)2 [Fe(NH3)4](OH)2 + Cu
Các phản ứng oxi hóa khử là (1), (3), (4), (5), (6), (8)
→ Chọn C.
15. Giải bài 35.15 trang 86 SBT Hóa học 12
Hoà tan hoàn toàn hỗn hợp gồm 0,12 mol FeS2 và a mol Cu2S vào axit HNO3 (vừa đủ) thu được dung dịch X (chỉ chứa 2 muối sunfat) và khí duy nhất NO. Giá trị của a là
A. 0,04. B. 0,075.
C. 0,12. D. 0,06.
Phương pháp giải
Dung dịch X thu được chứa Fe2(SO4)3 và CuSO4
Dung dịch X gồm: Fe3+ (0,12 mol), Cu2+ (2a mol), (0,24 + a) mol
Bảo toàn điện tích cho dung dịch X tìm được a.
Hướng dẫn giải
Dung dịch X thu được chứa Fe2(SO4)3 và CuSO4
Dung dịch X gồm: Fe3+ (0,12 mol), Cu2+ (2a mol), (0,24 + a) mol
Bảo toàn điện tích cho dung dịch X: + 2nCu2+=2n
3.0,12 + 2.2a = 2.(0,24 + a ) a = 0,06
→ Chọn D.
16. Giải bài 35.16 trang 86 SBT Hóa học 12
Cho 1,52 gam hỗn hợp Fe và Cu vào 200 ml dung dịch HNO3 sau khi phản ứng xảy ra hoàn toàn thu đươc dung dịch A và 224 ml khí NO duy nhất (đktc) đồng thời còn lại 0,64 gam chất rắn. Nồng độ mol của dung dịch HNO3 đã dùng ban đầu là
A. 0,1M. B. 0,25M.
C.0,2M. D. 0,5M.
Phương pháp giải
Viết phương trình bán phản ứng của HNO3, tính số mol HNO3 theo NO, từ đó tìm được nồng độ mol của dung dịch HNO3 đã dùng.
Hướng dẫn giải
Ta dùng phương trình bán phản ứng của HNO3:
\(4HN{O_3} + 3e \to NO + 3N{O_3}^ - + {H_2}O\)
\({n_{NO}} = 0,01mol \to {n_{HN{O_3}}} = 0,04mol\)
\({C_{M(HN{O_3})}} = \frac{{0,04}}{{0,2}} = 0,2M\)
Chọn C.
17. Giải bài 35.17 trang 86 SBT Hóa học 12
Nguyên tử đồng có 1 electron ở lớp ngoài cùng nhưng tại sao đồng có hoá trị II? Đồng tác dụng như thế nào với các axit?
Phương pháp giải
Dựa vào lí thuyết về Cu và các hợp chất của Cu giải thích tại sao đồng có 1 electron ở lớp ngoài cùng nhưng tại sao đồng có hoá trị II.
Hướng dẫn giải
Do Cu có phân lớp d đầy đủ nhưng cấu trúc chưa hoàn toàn bền vững nên nguyên tử có thể bị kích thích chuyển thành trạng thái 3d94s2 nên ngoai hóa trị I Cu thường có hóa trị II khi kết hợp với các nguyên tử khác
- Khả năng Cu tác dụng với các axit
+ Cu không tác dụng với các axit không có tính oxi hóa như HCl, H2SO4 (l)
+ Cu tác dụng với các axit có tính oxi hóa như H2SO4(đ), HNO3,…
Cu + 2H2SO4 (đ) → CuSO4 + SO2 + 2H2O
3Cu + 8HNO3 (l) → 3Cu(NO3)2 + 2NO + 4H2O
Cu + 4HNO3 (đ) → Cu(NO3)2 + 2NO2 + 2H2O
18. Giải bài 35.18 trang 86 SBT Hóa học 12
Bột đồng có lẫn tạp chất là bột thiếc, kẽm, chì. Hãy nêu phương pháp hoá học đơn giản để loại bỏ tạp chất. Viết phương trình hoá học của phản ứng dạng phân tử và ion thu gọn.
Phương pháp giải
Dựa vào tính chất hóa học đặc trưng của Cu để lựa chọn thuốc thử và phương pháp hoá học đơn giản để loại bỏ tạp chất.
Hướng dẫn giải
Cho bột đồng lẫn tạp chất bột thiếc, kẽm, chì hòa tan vào dung dịch CuSO4 thì các tạp chất đều bị hòa tan còn lại bột đồng. Lọc tách ta được đồng nguyên chất
Các phản ứng xảy ra:
Zn + CuSO4 → ZnSO4 + Cu
Zn + Cu2+ → Zn 2+ + Cu
Sn + CuSO4 → SnSO4 + Cu
Sn + Cu2+ → Sn2+ + Cu
Pb + CuSO4 → PbSO4 +Cu
Pb + Cu2+ → Pb2+ + Cu.
19. Giải bài 35.19 trang 87 SBT Hóa học 12
Malachit có công thức hoá học là CuCO3.Cu(OH)2. Trình bày các phương pháp điều chế Cu từ chất này.
Phương pháp giải
Cần nắm rõ phương pháp điều chế Cu từ CuCO3.Cu(OH)2 để viết phương trình hóa học.
Hướng dẫn giải
Cách 1:
\(CuC{O_3}.Cu{(OH)_2}\xrightarrow{{{t^o}}}2CuO + C{O_2} + {H_2}O\)
\(CuO + {H_2}\xrightarrow{{{t^o}}}Cu + {H_2}O\)
Cách 2:
\(CuC{O_3}.Cu{(OH)_2} + HCl \to 2CuC{l_2} + C{O_2} + 3{H_2}O\)
\(CuC{l_2}\xrightarrow{{dp{\text{dd}}}}Cu + C{l_2}\)
20. Giải bài 35.20 trang 87 SBT Hóa học 12
Chia 4 g hỗn hợp bột kim loại gồm Al, Fe, Cu thành hai phần đều nhau
- Cho phần (1) tác dụng với lượng dư dung dịch HCl, thu được 560 ml H2
- Cho phần (2) tác dụng với lượng dư dung dịch NaOH, thu được 336 ml H2.
Các thể tích khí đo ở đktc. Tính thành phần phần trăm khối lượng của từng kim loại trong hỗn hợp.
Phương pháp giải
- Bước 1: Viết PTHH cho phản ứng trong mỗi phần
- Bước 2: Trong phản ứng với dung dịch NaOH tìm được số mol Al
- Bước 3: Trong phản ứng với dung dịch HCl tìm được số mol Fe
- Bước 4: Tính được khối lượng và phần trăm khối lượng của Al và Fe, suy ra % khối lượng của Cu
Hướng dẫn giải
Phần 1:
Cl → 2AlCl3 + 3H2 (1)
Fe + 2HCl → FeCl2 + H2 (2)
Phần 2:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 (3)
Từ pt (3): = 2/3nH2= 2/3.0,336/22,4 = 0,01mol
→mAl = 0,27g
Theo (1), (2) và (3) ta có: V H2 (2) = 560-336 =224(ml)
Theo (2) ta có: = nH2 = 0,224/22,4 = 0,01 (mol)→mFe = 0,56g
= 0,27/2.100 = 13,5%; %mFe = 0,56/2.100=28%; %mCu= 58,5%
21. Giải bài 35.21 trang 87 SBT Hóa học 12
Thực hiện hai thí nghiệm :
1) Cho 3,84 gam Cu phản ứng với 80 ml dung dịch HNO31M thoát ra V1 lít NO.
2) Cho 3,84 gam Cu phản ứng với 80 ml dung dịch chứa HNO3 1M và H2S04 0,5M thoát ra V2 lít NO.
Biết NO là sản phẩm khử duy nhất, các thể tích khí đo ở cùng điều kiện. Lập biểu thức biểu diễn mối quan hệ giữa V1 và V2.
Phương pháp giải
- Bước 1: Viết phương trình ion cho phản ứng trong mỗi thí nghiệm
- Bước 2: So sánh dư hết cho các ion tham gia phản ứng, tính số mol khí NO theo ion phản ứng hết
- Bước 3: Lập mối quan hệ giữa V1 và V2
Hướng dẫn giải
Ta viết PTHH dạng ion rút gọn cho cả hai thí nghiệm như sau :
3Cu + 8H+ + 2NO3 ⟶ 3Cu2+ + 2NO + 4H2O
Thí nghiệm 1 : ta có số mol các chất và ion : Cu : 0,06 mol; H+ : 0,08 mol; NO3- : 0,08 mol.
H+ phản ứng hết ⟹ VNO = V1 = .22,4 = 0,448 (lít) (1)
Thí nghiệm 2 : ta có số mol các'chất và ion : Cu : 0,06 mol; H+ : 0,16 mol; NO3- : 0,08 mol.
H+ và Cu phản ứng vừa đủ ⟹ VNO = V2 = .22,4 = 0,896 (lít) (2)
Từ (1) và (2) ⟹ V2 = 2V1.
Tham khảo thêm
- doc Giải bài tập SBT Hóa 12 Bài 31: Sắt
- doc Giải bài tập SBT Hóa 12 Bài 32: Hợp chất của sắt
- doc Giải bài tập SBT Hóa 12 Bài 33: Hợp kim của sắt
- doc Giải bài tập SBT Hóa 12 Bài 34: Crom và hợp chất của crom
- doc Giải bài tập SBT Hóa 12 Bài 36: Sơ lược về niken, kẽm, chì, thiếc
- doc Giải bài tập SBT Hóa 12 Bài 37: Luyện tập Tính chất hóa học của sắt và hợp chất của sắt
- doc Giải bài tập SBT Hóa 12 Bài 38: Luyện tập tính chất của crom, đồng và hợp chất của chúng
