Giải bài tập SGK Hóa 10 Nâng cao Bài 27: Luyện tập Chương 4
Dưới đây là nội dung chi tiết Giải bài tập nâng cao Hóa 10 Chương 4 Bài 27, với hướng dẫn giải chi tiết, rõ ràng, trình bày khoa học. eLib hy vọng đây sẽ là tài liệu hữu ích giúp các bạn học sinh lớp 10 học tập thật tốt!
Mục lục nội dung
1. Giải bài 1 trang 102 SGK Hóa học 10 nâng cao
2. Giải bài 2 trang 112 SGK Hóa học 10 nâng cao
3. Giải bài 3 trang 112 SGK Hóa học 10 nâng cao
4. Giải bài 4 trang 112 SGK Hóa học 10 nâng cao
5. Giải bài 5 trang 112 SGK Hóa học 10 nâng cao
6. Giải bài 6 trang 113 SGK Hóa học 10 nâng cao
7. Giải bài 7 trang 113 SGK Hóa học 10 nâng cao
8. Giải bài 8 trang 113 SGK Hóa học 10 nâng cao
9. Giải bài 9 trang 113 SGK Hóa học 10 nâng cao

1. Bài 1 trang 112 SGK Hóa 10 nâng cao
Trong phản ứng hóa học sau: Cl2 + 6KOH → KClO3 + 5KCl + 3H2O. Cl2 đóng vai trò gì?
A. Chỉ là chất oxi hóa.
B. Chỉ là chất khử.
C. Vừa chất oxi hóa, vừa là chất khử.
D. Không phải chất oxi hóa, không phải chất khử,
Phương pháp giải
- Chất oxi hóa: là chất chứa nguyên tố có số oxi hóa giảm.
- Chất khử: là chất chứa nguyên tố có số oxi hóa tăng.
Hướng dẫn giải
Chọn C.
Cl2 + 6KOH → KClO3 + 5KCl + 3H2O
Số oxi hóa của cl2 vừa tăng vừa giảm nên Cl2 vừa là chất oxi hóa vừa là chất khử
2. Bài 2 trang 112 SGK Hóa 10 nâng cao
Trong phản ứng hóa học sau:
3K2MnO4 + 2H2O → 2KMnO4 + MnO2 + 4KOH, nguyên tố mangan đóng vai trò gì?
A. Chỉ bị oxi hóa.
B. Chỉ bị khử.
C. Vừa bị oxi hóa, vừa bị khử.
D. Không bị oxi hóa, không bị khử.
Tìm đáp án đúng.
Phương pháp giải
- Chất oxi hóa: là chất chứa nguyên tố có số oxi hóa giảm.
- Chất khử: là chất chứa nguyên tố có số oxi hóa tăng.
Hướng dẫn giải
Chọn C
3K2MnO4 + 2H2O → 2KMnO4 + MnO2 + 4KOH
Ta thấy số oxi hóa của nguyên tố Mn vừa tăng và vừa giảm nên nó vừa là chất oxi hóa, vừa là chất khử.
3. Bài 3 trang 112 SGK Hóa 10 nâng cao
Những câu sau đây là đúng hay sai?
A. Nhiên liệu là chất oxi hóa.
B. Khi đốt cháy hoàn toàn một hiđrocacbon, nguyên tố cacbon chuyển thành cacbon monooxit.
C. Sự chuyển một chất từ trạng thái lỏng sang trạng thái rắn là một biến đổi vật lí tỏa nhiệt.
D. Sự bay hơi là một biến đổi hóa học
Phương pháp giải
Để giải bài tập này cần nắm vững kiến thức lý thuyết chương 4
Hướng dẫn giải
Câu đúng là A, C.
Câu sai là B, D.
Khi đốt cháy hoàn toàn một hiđrocacbon, nguyên tố cacbon chuyển thành cacbon đioxit.
Sự bay hơi là sự biến đổi vật lí.
4. Bài 4 trang 112 SGK Hóa 10 nâng cao
Hãy nêu ví dụ về phản ứng phân hủy tạo ra:
a) hai đơn chất.
b) hai hợp chất.
c) một đơn chất và một hợp chất..
Hãy cho biết các phản ứng đó có phải là phản ứng oxi hóa-khử hay không? Giải thích.
Phương pháp giải
- Phản ứng phân huỷ: là phản ứng hóa học, trong đó một chất bị phân hủy thành 2 hay nhiều chất mới
- Trong phản ứng phân huý, số oxi hoá của các nguyên tố có thể thay đổi hoặc không thav đổi.
Hướng dẫn giải
Phản ứng phân hủy
Câu a: Hai đơn chất: 2HgO→ 2Hg + O2 ;
H2S →H2 + S
Câu b: Hai hợp chất: Cu(OH)2 → CuO+ H2O
CaCO3→ CaO + CO2
Câu c: Một đơn chất và một hợp chất: 2KClO3 → 2KCl + 3O2
2KNO3 → 2KNO2 + O2
Ở a) và c) là phản ứng oxi hóa khử vì số oxi hóa của các nguyên tố thay đổi;
Ở b) không phải phản ứng oxi hóa khử vì số oxi hóa không thay đổi.
5. Bài 5 trang 112 SGK Hóa 10 nâng cao
Hãy nêu ra ví dụ về phản ứng hóa hợp của:
a) hai đơn chất.
b) hai hợp chất.
c) một đơn chất và một hợp chất.
Hãy cho biết các phản ứng đó có phải là phản ứng oxi hóa-khử hay không? Giải thích.
Phương pháp giải
- Phản ứng hoá hợp là phản ứng hóa học, trong đó 2 hay nhiều chất hóa hợp với nhau tạo thành một chất mới.
- Tгопg phản ứng hoá hợp, số oxi hoá của các nguyên tố có thể thay đổi hoặc không thay đổi.
Hướng dẫn giải
Phản ứng hóa hợp:
Câu a: Hai đơn chất: 2H2 + O2 → 2H2O; 2K + Cl2 → 2KCl
Câu b: Hai hợp chất: CaO + H2O → Ca(OH)2 ; SO3 + H2O → H2SO4
Câu c: Từ một đơn chất và một hợp chất: 2SO2 + O2 → 2SO3;
4FeO + O2 → 2Fe2O3
Ở a) và c) là phản ứng oxi hóa khử vì số oxi hóa của các nguyên tố thay đổi;
ở b) không phải phản ứng oxi hóa khử vì số oxi hóa không thay đổi.
6. Bài 6 trang 113 SGK Hóa 10 nâng cao
Hãy nêu ví dụ về phản ứng tạo ra muối từ:
a) hai đơn chất,
b) hai hợp chất.
c) một đơn chất và một hợp chất.
Hãy cho biết các phản ứng đó có phải là phản ứng oxi hóa-khử hay không? Giải thích.
Phương pháp giải
Cần nắm được một số loại phản ứng sau:
+ Phản ứng hóa hợp
+ Phản ứng trao đổi
+ Phản ứng thế
Hướng dẫn giải
Phản ứng tạo muối.
Câu a: Từ hai đơn chất: Fe + S → FeS ; 2Na + Cl2 → 2NaCl
Câu b: Từ hai hợp chất: HCl + KOH → KCl + H2O ; K2O + CO2 → K2CO3
Câu c: Từ một đơn chất và một hợp chất: Al + 6HNO3 → Al(NO3)3 + 3NO2 +3H2O
Cl2 + 2KOH → KCl + KClO + H2O
Ở phản ứng a) và c) là phản ứng oxi hóa khử vì có sự thay đổi số oxi hóa của các nguyên tố.
Ở phản ứng b) không phải phản ứng oxi hóa khử vì không có sự thay đổi số oxi hóa.
7. Bài 7 trang 113 SGK Hóa 10 nâng cao
NaOH có thể được điều chế bằng:
a) Một phản ứng hóa hợp.
b) Một phản ứng thế.
c) Một phản ứng trao đổi.
- Hãy dẫn ra phản ứng hóa học cho mỗi trường hợp trên.
- Hãy cho biết các phản ứng đó có phải là phản ứng oxi hóa-khử hay không? Giải thích.
Phương pháp giải
- Phản ứng thế: là phản ứng hóa học, trong đó nguyên tử của nguyên tố này ở dạng đơn chất thay thế nguyên tử của nguyên tố khác trong hợp chất
- Phản ứng trao đổi: là phản ứng hóa học, trong đó các hợp chất trao đổi nguyên tử hay nhóm nguyên tử với nhau
Hướng dẫn giải
Phản ứng điều chế NaOH
Câu a: Một phản ứng hóa hợp: Na2O + H2O → 2NaOH.
Câu b: Một phản ứng thế: 2Na + 2H2O → 2NaOH + H2
Câu c: Một phản ứng trao đổi: Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3
Ở phản ứng b) là phản ứng oxi hóa-khử vì có sự thay đổi số oxi hóa của các nguyên tố trước và sau phản ứng; phản ứng a) và c) không là phản ứng oxi hóa khử vì không có sự thay đổi số oxi hóa,
8. Bài 8 trang 113 SGK Hóa 10 nâng cao
Hãy cho biết số oxi hóa của nitơ trong các phân tử và ion dưới đây:
Đinitơ oxit N2O; Axit nitric HNO3; Ion nitrit NO2-;
Hidrazin N2H4; Hiđroxylamin NH2OH; AmoniacNH3;
Nitơ đioxit NO2; Ion nitrat NO3-; Ion hidrazini N2H5;
Axit nitrơ HNO2; Đinitơ pentaoxit N2O5; lon amoni NH4+;
Khí nitơ N2; Nitơ monooxit NO; Đinitơ tetraoxit N2O4.
Phương pháp giải
Quy tắc xác định số oxi hóa
- Quy tắc 1: Số oxi hóa của các nguyên tố trong đơn chất bằng 0.
- Quy tắc 2: Trong hầu hết các hợp chất:
Số oxi hóa của H là +1 (trừ các hợp chất của H với kim loại như NaH, CaH2, thì H có số oxi hóa –1).
Số oxi hóa của O là –2 (trừ một số trường hợp như H2O2, F2O, oxi có số oxi hóa lần lượt là : –1, +2).
- Quy tắc 3: Trong một phân tử, tổng đại số số oxi hóa của các nguyên tố bằng 0. Theo quy tắc này, ta có thể tìm được số oxi hóa của một nguyên tố nào đó trong phân tử nếu biết số oxi hóa của các nguyên tố còn lại.
- Quy tắc 4: Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích của ion đó. Trong ion đa nguyên tử, tổng đại số số oxi hóa của các nguyên tử trong ion đó bằng điện tích của nó.
Hướng dẫn giải
Số oxi hóa của nitơ trong các phân tử và ion là:
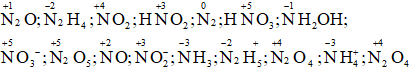
9. Bài 9 trang 113 SGK Hóa 10 nâng cao
Lập phương trình hóa học của các phản ứng oxi hóa-khử dưới đây:
a) NaClO + KI + H2SO4 → I2 + NaCl + K2SO4 + H2O
b) Cr2O3 + KNO3 + KOH → K2CrO4 +H2O + KNO2
c) Al + Fe3O4 → Al2O3 + Fe
d) FeS4 + O2 → Fe2O3 + SO2
e) Mg + HNO3→Mg(NO3)2 + NH4NO3 + H2O.
Phương pháp giải
- Bước 1: Xác định số oxh của các nguyên tố để tìm chất oxi hoá và chất khử.
- Bước 2: Viết quá trình oxh và quá trình khử, cân bằng mỗi quá trình.
- Bước 3: Tìm hệ số thích hợp cho chất oxh và chất khử sao cho tổng số electron cho bằng tổng số electron nhận.
- Bước 4: Đặt hệ số của các chất oxh và khử vào sơ đồ phản ứng, từ đó tính ra hệ số các chất khác. Kiểm tra cân bằng số nguyên tử của các nguyên tố và cân bằng điện tích hai vế để hoàn thành PTHH.
Hướng dẫn giải
Câu a:
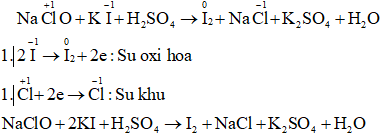
Câu b:
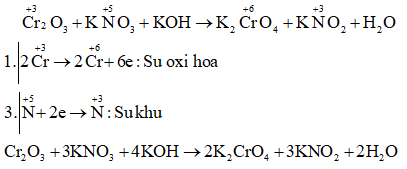
Câu c:
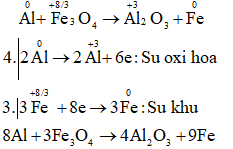
Câu d:
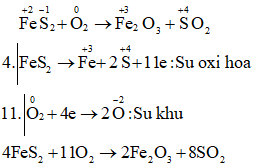
Câu e:
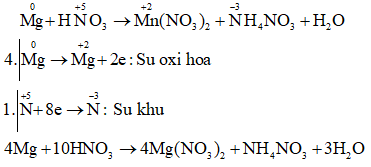
10. Bài 10 trang 113 SGK Hóa 10 nâng cao
Hoàn thành các phương trình hóa học dưới đây:
a) KMnO2 + HCl → Cl2 + MnCl2 + ...
b) SO2 + HNO3+ H2O → NO + ...
c) AS2S3 + HNO3 + H2O → H3ASO4 + NO + H2SO4
Phương pháp giải
- Bước 1: Xác định số oxh của các nguyên tố để tìm chất oxi hoá và chất khử.
- Bước 2: Viết quá trình oxh và quá trình khử, cân bằng mỗi quá trình.
- Bước 3: Tìm hệ số thích hợp cho chất oxh và chất khử sao cho tổng số electron cho bằng tổng số electron nhận.
- Bước 4: Đặt hệ số của các chất oxh và khử vào sơ đồ phản ứng, từ đó tính ra hệ số các chất khác. Kiểm tra cân bằng số nguyên tử của các nguyên tố và cân bằng điện tích hai vế để hoàn thành PTHH
Hướng dẫn giải
Câu a:
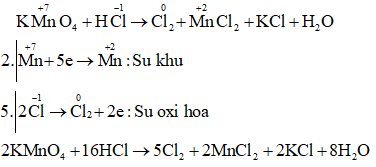
Câu b:
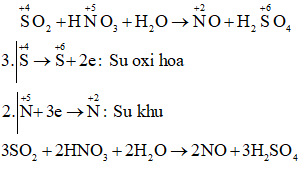
Câu c:
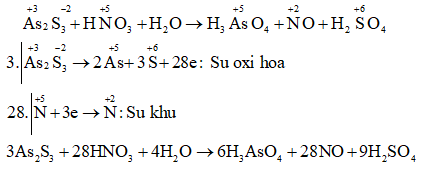
11. Bài 11 trang 113 SGK Hóa 10 nâng cao
Cho kali iotua tác dụng với kali pemanganat trong dung dịch axit sunfuric, ngựời ta thu dựợc l,2g mangan (II) sunfat.
a) Tính số gam iot tạo thành.
b) Tính khối lượng kalii otua tham gia phản ứng.
Phương pháp giải
10KI + 2KMnO4 + 8H2SO4 → 6K2SO4 + 2MnSO4 + 5I2 + 8H2O (1)
nI2 = 5/2. nMnSO4 = ?
⇒ Khối lượng iot tạo thành?
nKI = 5nMnO4 = ?
⇒ Khối lượng kali iotua tham gia phản ứng ?
Hướng dẫn giải
Câu a: Tính số gam iot tạo thành
Phản ứng xảy ra:
10KI + 2KMnO4 + 8H2SO4 → 6K2SO4 + 2MnSO4 + 5I2 + 8H2O (1)
Ta có: nMnSO4 = 1,2/151 mol
Theo (1): nI2 = 5/2. nMnSO4 ≈ 0,02mol
⇒ Khối lượng iot tạo thành là: 0,02. 254 = 5,08 (gam)
Câu b: Tính khối lượng kali iotua tham gia phản ứng:
Từ (1) ⇒ \({n_{KI}} = 5{n_{Mn{O_4}}} = 5.\frac{{1,2}}{{151}} = 0,04mol\)
⇒ Khối lượng kali iotua tham gia phản ứng là:
mKI = 0,04. 166 = 6,64 (g)
