Giải bài tập SGK Hóa 10 Nâng cao Bài 3: Đồng vị, Nguyên tử khối và nguyên tử khối trung bình
Dựa theo nội dung SGK Hóa học nâng cao 10 eLib xin giới thiệu đến các em học sinh bài giải Đồng vị, Nguyên tử khối và nguyên tử khối trung bình. Bài này sẽ giúp các em nắm vững được lý thuyết cũng như cách giải các bài tập đầy đủ, chi tiết và rõ ràng. Hy vọng đây sẽ là tài liệu tham khảo hữu ích với các em học sinh.
Mục lục nội dung

1. Giải bài 1 trang 14 SGK Hóa 10 nâng cao
Nguyên tố cacbon có hai đồng vị bền:
\(_6^{12}C\) chiếm 98,89% và \(_6^{13}C\) chiếm 1,11%
Nguyên tử khối trung bình của nguyên tố cacbon là:
A. 12,500.
B. 12,011.
C. 12,022.
D. 12,055.
Phương pháp giải
Áp dụng công thức
\({\overline A _X} = \frac{{{A_1}.x + {A_2}.y + {A_3}.z + ...}}{{100}}\)
Hướng dẫn giải
Chọn B.
Ta có:
\({\overline M _C} = \frac{{12.98,89 + 13.1,11}}{{100}} = 12,011\)
2. Giải bài 2 trang 14 SGK Hóa 10 nâng cao
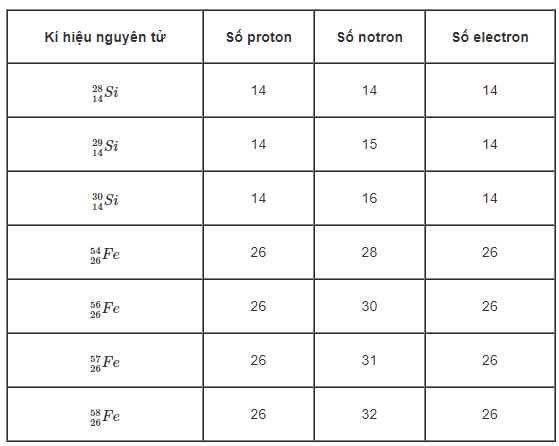
Cho biết số proton, số nơtron và số electron của các đồng vị sau đây:
a) \(_{14}^{28}Si\) , \(_{14}^{29}Si\) , \(_{14}^{30}Si\) .
b) \(_{26}^{54}Fe\) , \(_{26}^{56}Fe\) , \(_{26}^{57}Fe\) , \(_{26}^{58}Fe\) .
Phương pháp giải
Dựa vào kí hiệu hóa học để tìm số p, n, e
Hướng dẫn giải
3. Giải bài 3 trang 14 SGK Hóa 10 nâng cao
Nguyên tử khối trung bình của bạc bằng 107,02 lần nguyên tử khối của hiđro. Nguyên tử khối của hiđro bằng,1,008. Tính nguyên tử khối trung bình của bạc.
Phương pháp giải
AAg = 107,02.MH
Hướng dẫn giải
Theo đề bài, ta có:
AAg = 107,02.MH = 107,02.1,008 = 107,876 u.
4. Giải bài 4 trang 14 SGK Hóa 10 nâng cao
Cho hai đồng vị hiđro và hai đồng vị của clo với tỉ lệ phần trăm số nguyên tử chiếm trong tự nhiên như sau:
\(_1^1H\) (99,984%); \(_1^2H\) (0,016%) và \(_{17}^{35}Cl\) (75,77%) ; \(_{17}^{37}Cl\) (24,23%)
a) Tính nguyên tử khối trung bình của mỗi nguyên tố
b) Có thể có bao nhiêu loại phân tử HCl khác nhau tạo nên từ hai đồng vị của hai nguyên tố đó?
c) Tính phân tử khối của mỗi loại phân tử nói trên.
Phương pháp giải
Áp dụng công thức
\({\overline A _X} = \frac{{{A_1}.x + {A_2}.y + {A_3}.z + ...}}{{100}}\)
Hướng dẫn giải
Câu a: Nguyên tử khối trung bình mỗi nguyên tố.
Áp dụng công thức:
\(\overline A = \frac{{aA + bB}}{{a + b}}\)
Ta tính được:
\(\begin{array}{l}
{\overline A _H} = 1,00016u\\
{\overline A _{Cl}} = 35,4846u
\end{array}\)
Câu b: Kí hiệu \(_1^2H\) là D
Các loại phân tử hiđro clorua có thể có:
Công thức phân tử:
\(H_{17}^{35}Cl\) ; \(H_{17}^{37}Cl\) ; \(D_{17}^{35}Cl\) ; \(D_{17}^{37}Cl\) .
Câu c: Phân tử khối tương ứng của bốn loại trên là: 36; 38; 37; 39.
5. Giải bài 5 trang 14 SGK Hóa 10 nâng cao
Nguyên tử khối trung bình của đồng bằng 63,546. Trong tự nhiên, đồng có hai đồng vị \(_{29}^{63}Cu\) và \(_{29}^{65}Cu\) . Tính tỉ lệ phần trăm số nguyên tử của đồng vị \(_{29}^{63}Cu\) tồn tại trong tự nhiên.
Phương pháp giải
Áp dụng công thức
\({\overline A _X} = \frac{{{A_1}.x + {A_2}.y + {A_3}.z + ...}}{{100}}\)
Trong đó A1X (x%), A2X (y%), A3X (z%)…
Hướng dẫn giải
Gọi X là phần trăm của đồng vị \(_{29}^{63}Cu\)
⇒ Phần trăm của đồng vị \(_{29}^{65}Cu\) là (100 – x )
Ta có:
\({\overline A _{Cu}} = \frac{{63.x + 65.(100 - x)}}{{100}} = 63,546 \to x \approx 73\)
Vậy tỉ lệ phần trăm số nguyên tử của đồng vị \(_{29}^{63}Cu\) là 73%.
6. Giải bài 6 trang 14 SGK Hóa 10 nâng cao
Cho hai đồng vị \(_1^1H\) (kí hiệu là H) và \(_1^2H\) (kí hiệu là D)
a) Viết các công thức phân tử hiđro có thể có.
b) Tính phân tử khối của mỗi loại phân tử.
c) Một lít khí hiđro giàu đơteri ở điều kiện tiêu chuẩn nặng 0,05gam. Tính thành phần phần trăm khối lượng từng đồng vị của hiđro.
Phương pháp giải
- Có 3 loại công thức phân tử hiđro là: H2; HD; D2.
- Tính phân tử khối dựa vào công thức hóa học
- Tính % đồng vị \({\overline A _X} = \frac{{{A_1}.x + {A_2}.y + {A_3}.z + ...}}{{100}}\)
Hướng dẫn giải
Câu a: Có 3 loại công thức phân tử hiđro là: H2; HD; D2.
Câu b: Phân tử khối của mỗi phân tử là:
H2: 1. 2 =2 đvC
HD: 1 + 2= 3 đvC
D2: 2.2 = 4 đvC
Câu c: 1 lít khí nặng 0,05 g ⇒ 1 mol (22,4 l) nặng 0,05. 22,4 = 1,12g
⇒ AH = 1,12 g/mol
Gọi x là phần trăm của đồng vị D
⇒ phần trăm của đồng vị H là (100 - x)
Ta có: \(\frac{{2.x}}{{100}} + \frac{{1.(100 - x)}}{{100}} = 1,12\)
Giải ra được %D = 12%; %H = 88%.
Tham khảo thêm
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 1: Thành phần nguyên tử
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 2: Hạt nhân nguyên tử, Nguyên tố hóa học
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 4: Sự chuyển động của electron trong nguyên tử, Obitan nguyên tử
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 5: Luyện tập
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 6: Lớp và phân lớp electron
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 7: Năng lượng của các electron trong nguyên tử, Cấu hình electron nguyên tử
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 8: Luyện tập Chương 1
