Giải bài tập SGK Hóa 9 Bài 16: Tính chất hóa học của kim loại
Nội dung hướng dẫn Giải bài tập Hóa 9 Bài 16 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về tính chất hóa học của kim loại. Mời các em cùng theo dõi.
Mục lục nội dung

1. Giải bài 1 trang 51 SGK Hóa 9
Kim loại có những tính chất hóa học nào? Lấy ví dụ và viết các phương trình hóa học minh họa với kim loại magie.
Phương pháp giải
Kế tên các tính chất hóa học của kim loại sau đó viết PTHH:
- Tác dụng với phi kim.
- Tác dụng với dung dịch axit.
- Tác dụng với dung dịch muối.
Hướng dẫn giải
Tính chất hóa học của kim loại:
- Phản ứng của kim loại với phi kim:
2Mg + O2 → 2MgO
Mg + Cl2 → MgCl2
- Phản ứng của kim loại với dung dịch axit:
Mg + 2HCl → MgCl2 + H2↑
Mg + H2SO4loãng → MgSO4 + H2↑
- Phản ứng của kim loại với dung dịch muối:
Mg + CuSO4 → MgSO4 + Cu
2. Giải bài 2 trang 51 SGK Hóa 9
Hãy hoàn thành các phương trình hóa học sau đây:
a) ... + HCl → MgCl2 + H2
b) ... + AgNO3 → Cu(NO3)2 + Ag
c) ... + ... → ZnO
d) ... + Cl2 → HgCl2
e) ... + S → K2S
Phương pháp giải
Để điền những công thức phù hợp vào chỗ trống cần dựa vào những chất có sẵn và tính chất chất hóa học của từng phản ứng
Hướng dẫn giải
a) Mg + 2HCl → MgCl2 + H2 ↑
b) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
c) 2Zn + O2 \(\xrightarrow{{{t^o}}}\) 2ZnO
d) Cu + Cl2 \(\xrightarrow{{{t^o}}}\) CuCl2
e) 2K + S —> K2S
3. Giải bài 3 trang 51 SGK Hóa 9
Viết các phương trình hóa học xảy ra giữa các cặp chất sau đây:
a) Kẽm + axit sunfuric loãng.
b) Kẽm + dung dịch bạc nitrat.
c) Natri + lưu huỳnh.
d) Canxi + clo.
Phương pháp giải
Để viết phương trình hóa học cần biết công thức hóa học từ tên gọi của chất đó và dựa vào tính chất hóa học để suy ra sản phẩm phù hợp.
Hướng dẫn giải
Các phương trình hóa học
a) Zn + H2SO4 → ZnSO4 + H2 ↑
b) Zn + 2AgNO3 → Zn(NO3)2 + 2Ag ↓
c) 2Na + S → Na2S
d) Ca + Cl2 \(\xrightarrow{{{t^o}}}\) CaCl2
4. Giải bài 4 trang 51 SGK Hóa 9
Dựa vào tính chất hoá học của kim loại, hãy viết các phương trình hoá học biểu diễn các chuyển đổi sau đây:
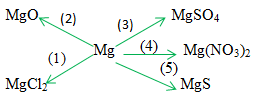
Phương pháp giải
Để viết các phương trình hoá học biểu diễn các chuyển đổi trên ta cần nắm rõ tính chất hóa học của kim loại, từ những chất đã có suy ra những chất còn lại của phương trình hóa học.
Hướng dẫn giải
Các phương trình hóa học của dãy chuyển hóa trên là:
(1) Mg + Cl2 \(\xrightarrow{{{t^o}}}\) MgCl2
(2) 2Mg + O2 \(\xrightarrow{{{t^o}}}\) 2MgO
(3) Mg + H2SO4loãng → MgSO4 + H2↑
(4) Mg + 2AgNO3 → Mg(NO3)2 + 2Ag↓
(5) Mg + S → MgS
5. Giải bài 5 trang 51 SGK Hóa học 9
Dự đoán hiện tượng và viết phương trình hoá học khi:
a) Đốt dây sắt trong khí clo.
b) Cho một đinh sắt vào ống nghiệm đựng dung dịch CuCl2.
c) Cho một viên kẽm vào dung dịch CuSO4.
Phương pháp giải
Để đoán được hiên tượng của mỗi trường hợp ta dựa vào tính chất của kim loại để suy ra sản phẩm và hiện tượng.
Hướng dẫn giải
a) Hiện tượng: Sắt bị nóng chảy, bắn thành các hạt sáng đồng thời thu được FeCl3 có màu đỏ nâu
2Fe + 3Cl2 \(\xrightarrow{{{t^o}}}\) 2FeCl3
b) Hiện tượng: thanh sắt tan dần, có kim loại màu đỏ sinh ra bám vào đinh sắt đồng thời dung dịch màu xanh lam nhạt màu dần.
Fe + CuCl2 → FeCl2 + Cu↓ (màu đỏ)
c) Hiện tượng: Viên kẽm tan dần đến hết, màu xanh của dung dịch CuSO4 nhạt màu dần đồng thời xuất hiện kim loại màu đỏ
Zn + CuSO4 → ZnSO4 + Cu↓ (đỏ)
6. Giải bài 6 trang 51 SGK Hóa học 9
Ngâm một lá kẽm trong 20 gam dung dịch muối đồng sunfat 10% cho đến khi kẽm không tan được nữa. Tính khối lượng kẽm đã phản ứng với dung dịch trên và nồng độ phần trăm của dung dịch sau phản ứng.
Phương pháp giải
Để khối lượng kẽm đã phản ứng với dung dịch trên và nồng độ phần trăm của dung dịch ta thực hiện các bước sau:
- Bước 1: Đổi số mol CuSO4
- Bước 2: Viết PTHH: Zn + CuSO4 —> ZnSO4 + Cu ↓
- Bước 3: Đặt số mol Zn, ZnSO4 và Cu theo số mol của CuSO4
- Bước 4: Tính: m dd sau phản ứng = mddCuSO4 + mZn – m Cu giải phóng
- Bước 5: => C% ZnSO4 = ?
Hướng dẫn giải
MCuSO4 = 160 g/mol
\({n_{CuS{O_4}}} = \frac{{20 . 10}}{{100 . 160}} = 0,0125\;mol\)
Phương trình hóa học:
Zn + CuSO4 → ZnSO4 + Cu
nZn = nCuSO4 = 0,0125 (mol)
mZn = 0,0125.65 = 2,01 (gam)
Nồng độ phần trăm của dung dịch sau phản ứng:
\(C{\% _{ZnS{O_4}}} = \frac{{2,01 . 100\% }}{{20}} = 10,05\;\% \)
Vậy khối lượng kẽm đã phản ứng là 2,01 gam và nồng độ phần trăm của dung dịch sau phản ứng là 10,05%.
7. Giải bài 7 trang 51 SGK Hóa học 9
Ngâm một lá đồng trong 20 ml dung dịch bạc nitrat cho tới khi đồng không thể tan thêm được nữa. Lấy lá đồng ra, rửa nhẹ, làm khô và cân thì thấy khối lượng lá đồng tăng thêm 1,52 g. Hãy xác định nồng độ mol của dung dịch bạc nitrat đã dùng (giả thiết toàn bộ lượng bạc giải phóng bám hết vào lá đồng).
Phương pháp giải
Để xác định nồng độ mol của dung dịch bạc nitrat ta thực hiện các bước sau:
- Bước 1: Sử dụng phương pháp tăng giảm khối lượng
Gọi số mol của Cu phản ứng là x (mol)
- Bước 2: Viết PTHH: Cu + 2AgNO3 —> Cu(NO3)2 + 2Ag ↓
x —> 2x —> x —> 2x
- Bước 3: Khối lượng kim loại tăng = mAg sinh ra - mCu phản ứng
=> 2x.108 - 64x = 1,52
=> x = ?
=> Tính toán được các yêu cầu bài toán
Hướng dẫn giải
Phương trình hóa học:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag ↓
Theo phương trình hóa học, ta có:
1 mol Cu tác dụng với 2 mol AgNO3 thì khối lượng tăng 152g.
x mol Cu tác dụng với y mol AgNO3 thì khối lượng tăng 1,52g.
⇒ y = 0,02 mol AgNO3.
Nồng độ dung dịch AgNO3:
\(C_{M_{AgNO_{3}}}= \frac{n}{V} = \frac{0,02 }{0,02}= 1 \ (M)\)
Tham khảo thêm
- doc Giải bài tập SGK Hóa 9 Bài 15: Tính chất vật lí của kim loại
- doc Giải bài tập SGK Hóa 9 Bài 17: Dãy hoạt động hóa học của kim loại
- doc Giải bài tập SGK Hóa 9 Bài 18: Nhôm
- doc Giải bài tập SGK Hóa 9 Bài 19: Sắt
- doc Giải bài tập SGK Hóa 9 Bài 20: Hợp kim sắt Gang, thép
- doc Giải bài tập SGK Hóa 9 Bài 21: Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn
- doc Giải bài tập SGK Hóa 9 Bài 22: Luyện tập chương 2 Kim loại
- doc Giải bài tập SGK Hóa 9 Bài 24: Ôn tập học kì 1
