Giải bài tập SGK Hóa 10 Nâng cao Bài 46: Luyện tập chương 6
Dưới đây là Hướng dẫn giải Hóa 10 SGK nâng cao Chương 6 Bài 46 được eLib biên soạn và tổng hợp, nội dung bám sát theo chương trình SGK Hóa học 10 nâng cao giúp các em học sinh nắm vững phương pháp giải bài tập và ôn tập kiến thức hiệu quả hơn.
Mục lục nội dung
1. Giải bài 1 trang 190 SGK Hóa học 10 nâng cao
2. Giải bài 2 trang 190 SGK Hóa học 10 nâng cao
3. Giải bài 3 trang 190 SGK Hóa học 10 nâng cao
4. Giải bài 4 trang 190 SGK Hóa học 10 nâng cao
5. Giải bài 5 trang 191 SGK Hóa học 10 nâng cao
6. Giải bài 6 trang 191 SGK Hóa học 10 nâng cao
7. Giải bài 7 trang 191 SGK Hóa học 10 nâng cao
8. Giải bài 8 trang 191 SGK Hóa học 10 nâng cao

1. Giải bài 1 trang 190 SGK Hóa 10 nâng cao
Chất nào sau đây vừa có tính oxi hóa, vừa có tính khử?
A. O3.
B. H2SO4.
C. H2S.
D.H2O2
Phương pháp giải
- Chất oxi hóa là chất nhận e (ứng với số oxi hóa giảm)
- Chất khử là chất nhường e ( ứng với số oxi hóa tăng)
Hướng dẫn giải
Chọn D
H2O2 thể hiện tính khử:
2KMnO4 + 3H2SO4 + 5H2O2 → 2MnSO4 + 5O2 + K2SO4 + 8H2O
H2O2 thể hiện tính oxi hóa:
H2O2 + 2KI → I2 + 2KOH
Đáp án A và B: O3, H2SO4 chỉ có tính oxi hóa
Đáp án C: H2S chỉ có tinh khử
2. Giải bài 2 trang 190 SGK Hóa 10 nâng cao
Câu nào sau đây không diễn tả đúng tính chất của các chất?
A. O2 và O3 cùng có tính oxi hóa, nhưng O3 có tính oxi hóa mạnh hơn.
B. H2O và H2O2 cùng có tính oxi hóa, nhưng H2O có tính oxi hóa yếu hơn.
C. H2SO3 và H2SO4 cùng có tính oxi hóa, nhưng H2SO4 có tính oxi hóa mạnh hơn.
D. H2S và H2SO4 cùng có tính oxi hóa, nhưng H2S có tính oxi hóa yếu hơn.
Phương pháp giải
Dựa vào tính chất hóa học của O2, O3 và hợp chất của lưu huỳnh để trả lời bài tập này
Hướng dẫn giải
Chọn D
H2S chỉ có tính khử, không có tính oxi hóa
3. Giải bài 3 trang 190 SGK Hóa 10 nâng cao
Axit sunfuric tham gia phản ứng với các chất, tùy thuộc vào điều kiện của phản ứng (nồng độ của axit, nhiệt độ của phản ứng, mức độ hoạt động của chất khử) có những phản ứng hóa học:
H2SO4 + HI → I2 + H2S + H2O
H2SO4 + HBr → Br2 + SO2 + H2O
H2SO4 + Fe → Fe2(SO4)3 + SO2 + H2O
H2SO4 + Zn → ZnSO4 + SO2 + H2O
H2SO4 + Zn → ZnSO4 + S + H2O
H2SO4 + Zn → ZnSO4 + H2S + H2O
a) Hãy cho biết số oxi hóa của những nguyên tố nào thay đổi và thay đổi như thế nào?
b) Lập phương trình hóa học của những phản ứng trên.
c) Cho biết vai trò của những chất tham gia các phản ứng oxi hóa-khử trên.
Phương pháp giải
Dựa vào tính chất hóa học của H2SO4 để trả lời bài tập này
Các bước để lập PTHH bằng phương pháp thăng bằng electron
1. Xác định sự thay đổi số oxi hóa của các nguyên tố trong sơ đồ phản ứng.
2. Viết các quá trình oxi hóa và khử, cân bằng mỗi quá trình.
3. Tìm hệ số thích hợp để để nhân vào sao cho tổng số electron mà chất khử nhường bằng tổng số eletron mà chất oxi hóa nhận.
4. Đặt hệ số của chất khử và chất oxi hóa vào sơ đồ phản ứng.Hoàn thành phương trình hóa học.
Hướng dẫn giải
Câu a, b: Sự thay đổi số oxi hóa và lập phương trình phản ứng
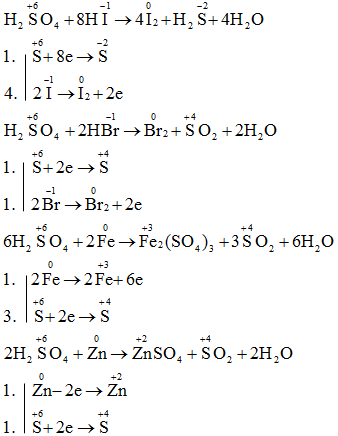
.png)
Câu c: Trong những phản ứng trên: H2SO4 là chất oxi hóa còn HI, HBr, Fe, Zn là các chất khử.
4. Giải bài 4 trang 190 SGK Hóa 10 nâng cao
Những dụng cụ bằng bạc hoặc đồng sẽ chuyển thành màu đen trong không khí hay trong nước có chứa hiđro sunfua, là do chúng bị phủ bằng một lớp muối sunfua kim loại có màu đen theo các phản ứng sau:
Ag + H2S + O2 → Ag2S + H2O
Cu + H2S + O2 → CuS + H2O
a) Hãy xác định số oxi hóa của những nguyên tố tham gia phản ứng oxi hóa - khử.
b) Lập phương trình hóa học của những phản ứng trên.
c) Cho biết vai trò của những chất tham gia phản ứng oxi hóa - khử.
Phương pháp giải
- Viết phương trình hóa học của phản ứng, từ đó xác định số oxi hóa
Hướng dẫn giải
Câu a: Số oxi hóa của nguyên tố tham gia phản ứng oxi hóa – khử:
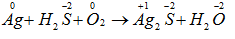
Số oxi hóa của Ag tăng từ 0 đến +1
Số oxi hóa của oxi giảm từ 0 xuống -2.
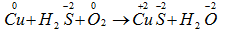
Số oxi hóa của Cu tăng từ 0 đến +2.
Số oxi hóa của oxi giảm từ 0 xuống -2.
Câu b: Cân bằng phản ứng oxi hóa - khử.
4Ag + 2H2S + O2 → 2Ag2S + 2H2O
2Cu + 2H2S + O2 → 2CuS + 2H2O
Câu c: Trong các phản ứng trên: chất khử là Ag, Cu còn chất oxi hóa là oxi.
5. Giải bài 5 trang 191 SGK Hóa 10 nâng cao
Nếu đốt Mg trong không khí rồi đưa vào bình đựng khí lưu huỳnh đioxit, nhận thấy có hai chất bột được sinh ra: bột A màu trắng và bột B màu vàng. Bột B không tác dụng với dung dịch axit sunfuric loãng, nhưng cháy được trong không khí, sinh ra khí D làm mất màu dung dịch kali pemanganat.
a) Hãy cho biết tên các chất A, B, D và giải thích.
b) Viết phương trình hóa học của các phản ứng đã xảy ra.
Phương pháp giải
Tên các chất A, B, D: Chất A: MgO; chất B: S; chất D: SO2
Từ bài toán viết PTHH của phản ứng
Hướng dẫn giải
Câu a: Tên các chất A, B, D: Chất A: MgO; chất B: S; chất D: SO2
Câu b: Các phản ứng:
2Mg + O2 → 2MgO
2Mg + SO2 → 2MgO + S
S + O2 → SO2
6. Giải bài 6 trang 191 SGK Hóa 10 nâng cao
Trong phòng thí nghiệm, người ta có thể điều chế khí clo bằng những phản ứng sau:
a) Dùng MnO2 oxi hóa dung dịch HCl đặc.
b) Dùng KMnO4 oxi hóa dung dịch HCl đặc.
c) Dùng H2SO4 đặc tác dụng với hỗn hợp NaCl và MnO2.
Hãy viết các phương trình hóa học.
Phương pháp giải
Dựa vào tính chất hóa học để viết PTHH của phản ứng
Hướng dẫn giải
Các phương trình phản ứng điều chế clo trong phòng thí nghiệm:
Câu a: MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
Câu b: 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Câu c: H2SO4 + 2NaCl → Na2SO4 + 2HCl
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
7. Giải bài 7 trang 191 SGK Hóa 10 nâng cao
Những hiđro halogenua nào có thể điều chế được khi cho axit sunfuric đặc tác dụng lần lượt với muối?
a) Natri florua
b) Natri clorua
c) Natri bromua
d) Natri iotua
Giải thích và viết phương trình hóa học.
Phương pháp giải
Dựa vào tính chất hóa học để viết PTHH của phản ứng
Chú ý: Tính khử và tính axit tăng dẫn từ HF đến HI
Hướng dẫn giải
Những hiđro halogenua sau có thể điều chế được khi cho H2SO4 đặc tác dụng với muối
Câu a: Natri florua: H2SO4 + 2NaF → 2HF + Na2SO4
Câu b: Natri clorua:
H2SO4 + NaCl → NaHSO4 + HCl
H2SO4 + 2NaCl → Na2SO4 + 2HCl
Những phản ứng của H2SO4 đặc tác dụng với các muối NaBr, NaI không thể điều chế được HBr, HI vì:
2NaBr + H2SO4 đặc → Na2SO4 + 2HBr
2HBr + H2SO4 đặc → Br2 + SO2↑ + 2H2O
2NaI + H2SO4 đặc → Na2SO4 + 2HI
8HI + H2SO4 đặc → 4I2 + H2S + 4H2O.
Chú ý: Tính khử và tính axit tăng dẫn từ HF đến HI
8. Giải bài 8 trang 191 SGK Hóa 10 nâng cao
Một bình kín đựng oxi ở nhiệt độ toC có áp suất P1(atm), sau khi phóng tia lửa điện để chuyển oxi thành ozon bình được đưa về nhiệt độ ban đầu, áp suất khí trong bình lúc này là P2. Tiếp tục dẫn khí trong bình qua dung dịch KI (dư), thu được dung dịch A và 2,2848 lít khí (điều kiện tiêu chuẩn).
a) Tính hiệu suất của quá trình ozon hóa. Biết rằng để trung hòa dung dịch A cần dùng 150ml dung dịch H2SO4 0,08M.
b) Tính P2 theo P1
Phương pháp giải
nH2SO4 = ?
⇒ nKOH = 2.nH2SO4 = ?
⇒ nO3 pư = nO2 sinh ra = 1/2. nKOH = ?
⇒ Hiệu suất phản ứng ?
Hướng dẫn giải
Câu a: nH2SO4 = 0,15.0,08 = 0,012 mol
nO2 dư + nO2 mới sinh = 2,2848/22,4 = 0,102 mol
3O2 → 2O3 (1)
0,018 ← 0,012 mol
O3 + 2KI + H2O → 2KOH + I2 + O2 (2)
0,012 ← 0,024 mol → 0,012
H2SO4 + 2KOH → K2SO4 + 2H2O (3)
0,012 mol → 0,024 mol
Từ pt (3) ⇒ nKOH = 2.nH2SO4 = 2.0,012 = 0,024 mol
Từ pt (2) ⇒ nO3 pư = nO2 sinh ra = 1/2. nKOH = 0,012 mol
Từ pt(1) ⇒ nO2 pư = 3/2. nO3 = 0,018 mol
⇒ nO2 ban đầu = 0,018 + 0,102 – 0,012 = 0,108 mol
Hiệu suất phản ứng là:
H% = (0,018/0,108). 100% = 16,67%
Câu b: Bình kín và nhiệt độ không đổi ta có:
\(\frac{{{P_1}}}{{{P_2}}} = \frac{{{n_1}}}{{{n_2}}} = \frac{{0,108}}{{0,102}} \to {P_2} = 0,944{P_1}\)
9. Giải bài 9 trang 191 SGK Hóa 10 nâng cao
a) Hãy xác định công thức của oleum A, biết rằng sau khi hòa tan 3,38 gam A vào nước, người ta phải cùng 800ml dung dịch KOH 0,1M để trung hòa dung dịch A.
b) Cần hòa tan bao nhiêu gam oleum A vào 200 gam nước để được dung dịch H2SO4 10%?
Phương pháp giải
H2SO4. nSO3 + nH2O → (n + 1) H2SO4
Ta có: \(\frac{{98 + 80n}}{{3,38}} = \frac{{n + 1}}{{0,04}}\)
→ n = ? → Công thức phân tử oleum?
Hướng dẫn giải
Oleum là dung dịch H2SO4 98% hấp thụ SO3 được oleum H2SO4.nSO3
H2SO4 + nSO3 → H2SO4.nSO3
Câu a: Xác định công thức oleum.
H2SO4 + 2KOH → K2SO4 + 2H2O (1)
Ta có: nKOH= 0,8.0,1 = 0,08 (mol)
Khi hòa tan oleum vào nước có quá trình:
H2SO4. nSO3 + nH2O → (n + 1) H2SO4 (2)
Từ (2) và đề bài, ta có:
\(\frac{{98 + 80n}}{{3,38}} = \frac{{n + 1}}{{0,04}}\)
Giải ra được n = 3.
Vậy công thức phân tử oleum là: H2SO4. 3SO3.
Câu b: Gọi a là số mol oleum H2SO4. 3SO3
Moleum = 98 + 240 = 338 u ⇒ moleum = 338a
Khi hòa tan oleum vào nước có phản ứng sau:
H2SO4. 3SO3 + 3H2O → 4H2SO4
1 4
a 4a
Khối lượng H2SO4 khi hòa tan a mol oleum: 98.4a = 392a
\(\frac{{392a}}{{338a + 200}} = \frac{{10}}{{100}} \to a = 0,0558mol\)
Vậy moleum phải dùng = 338.0,0558 = 18,86 (gam)
10. Giải bài 10 trang 191 SGK Hóa 10 nâng cao
Nung 81,95 gam hỗn hợp KCl, KNO3, và KClO3 (xúc tác thích hợp) đến khi khối lượng không đổi. Sản phẩm khí sinh ra tác dụng với hiđro, thu được 14,4 gam H2O. Sản phẩm rắn sinh ra được hòa tan trong nước rồi xử lí dung dịch này bằng dung dịch AgNO3, sinh ra 100,45gam AgCl kết tủa.
a) Viết các phương trình hóa học.
b) Xác định khối lượng mỗi muối trong hỗn hợp ban đầu
Phương pháp giải
Ta có hệ phương trình:
122,5x + 101y + 74,5z = 81,95; 1,5x + 0,5 y = 0,4 và 0,7 = x + z
⇒ x, y, z = ?
⇒ khối lượng mỗi muối trong hỗn hợp ban đầu.
Hướng dẫn giải
Câu a: KClO3 và KNO3 bị nhiệt phân
2KClO3 → 2KCl + 3O2 (1)
x x 1,5x
2KNO3 → 2KNO2 + O2 (2)
y 0,5y
2H2 + O2 → 2H2O (3)
0,4 0,8
KCl + AgNO3 → AgCl + KNO3 (4)
0,7 0,7
Câu b: Số mol H2O 0,8 mol; số mol AgCl 0,7 mol
Đặt số mol KClO3, KNO3 và KCl lần lượt là x mol, y mol và z mol
⇒ 122,5x + 101y + 74,5z = 81,95 (*)
Từ (1), (2) và (3) → 1,5x + 0,5 y = 0,4 (**)
Từ (4) → nKCl = 0,7 = x + z (***)
Giải hệ (*), (**) và (***) ta được x = y = 0,2; z = 0,5
Vậy mKClO3 = 24,5 gam; mKNO3 = 20,2 gam và mKCl = 37,25 gam
Tham khảo thêm
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 40: Khái quát về nhóm oxi
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 41: Oxi
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 42: Ozon và hiđro peoxit
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 43: Lưu huỳnh
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 44: Hiđro sunfua
- doc Giải bài tập SGK Hóa 10 Nâng cao Bài 45: Hợp chất có oxi của lưu huỳnh
