Giải bài tập SGK Hóa 9 Bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
eLib giới thiệu đến các em học sinh tài liệu Giải bài tập Sơ lược về bảng tuần hoàn các nguyên tố hoá học môn Hóa 9. Tài liệu hướng dẫn trả lời các câu hỏi trong SGK lớp 9 môn Hóa. Mời các em tham khảo chuẩn bị tốt cho bài học sắp tới
Mục lục nội dung

1. Giải bài 1 trang 101 SGK Hóa học 9
Dựa vào bảng tuần hoàn, hãy cho biết cấu tạo nguyên tử, tính chất kim loại, phi kim của các nguyên tố có số hiệu nguyên tử 7, 12, 16.
Phương pháp giải
Dựa vào bảng tuần hoàn các nguyên tố hóa học
Hướng dẫn giải
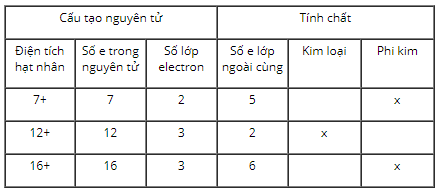
+ Giả sử nguyên tố A có số hiệu nguyên tử là 7 → A thuộc ô số 7 trong bảng tuần hoàn, có điện tích hạt nhân là 7+, có 7 electron. Dựa vào bảng tuần hoàn ta thấy nguyên tố A thuộc chu kì 2 → có 2 lớp electron. Nguyên tố A thuộc nhóm VA → có 5 electron lớp ngoài cùng và A là phi kim
+ Giả sử nguyên tố B có số hiệu nguyên tử là 12 → B thuộc ô số 12 trong bảng tuần hoàn, có điện tích hạt nhân là 12+, có 12 electron. Dựa vào bảng tuần hoàn ta thấy nguyên tố B thuộc chu kì 3 → có 3 lớp electron. Nguyên tố B thuộc nhóm IIA → có 2 electron lớp ngoài cùng và B là kim loại
+ Giả sử nguyên tố C có số hiệu nguyên tử là 16 → C thuộc ô số 16 trong bảng tuần hoàn, có điện tích hạt nhân là 16+, có 16 electron. Dựa vào bảng tuần hoàn ta thấy nguyên tố C thuộc chu kì 3 → có 3 lớp electron. Nguyên tố C thuộc nhóm VIA → có 6 electron lớp ngoài cùng và C là phi kim.
Ta được kết quả như trong bảng:
2. Giải bài 2 trang 101 SGK Hóa học 9
Biết X có cấu tạo nguyên tử như sau: điện tích hạt nhân là 11+, 3 lớp electron, lớp ngoài cùng có 1 electron. Hãy suy ra vị trí của X trong bảng tuần hoàn và tính chất hoá học cơ bản của nó
Phương pháp giải
- Điện tích hạt nhân cho biết số thứ tự của nguyên tố trong bảng tuần hoàn.
- Số lớp e cho biết chu kì của nguyên tố trong bảng tuần hoàn.
- Số e lớp ngoài cùng cho biết số thứ tự của nhóm trong bảng tuần hoàn.
Hướng dẫn giải
+ Vì điện tích hạt nhân là 11+ nên số thứ tự của nguyên tố là 11 (ô số 11)
+ Có 3 lớp electron → nguyên tố thuộc chu kì 3 của bảng tuần hoàn
+ Có 1 electron lớp ngoài cùng → nguyên tố thuộc nhóm I trong bảng tuần hoàn
Dựa vào bảng tuần hoàn các nguyên tố hóa học
+ Tên nguyên tố: natri
+ Kí hiệu hóa học: Na
+ Nguyên tử khối: 23
+ Tính chất hóa học cơ bản: kim loại
3. Giải bài 3 trang 101 SGK Hóa học 9
Các nguyên tố trong nhóm I đều là những kim loại mạnh tương tự natri : tác dụng với nước tạo thành dung dịch kiềm và giải phóng hiđro, tác dụng với oxi tạo thành oxit, tác dụng với phi kim khác tạo thành muối ... Viết các phương trình hoá học minh hoạ với kali.
Phương pháp giải
Các nguyên tố nhóm IA, chỉ có hóa trị là I trong các hợp chất và có tính chất hóa học tương tự natri.
Hướng dẫn giải
Kali tác dụng với nước tạo thành dung dịch bazơ và khí hiđro:
2K + 2H2O → 2KOH + H2
Kali tác dụng với oxi tạo thành oxit:
4K + O2 → 2K2O
Kali tác dụng với phi kim (khác oxi) tạo thành muối:
2K + Cl2 → 2KCl
4. Giải bài 4 trang 101 SGK Hóa học 9
Các nguyên tố nhóm VII đều là những phi kim mạnh tương tự clo (trừ At): tác dụng với hầu hết kim loại tạo muối, tác dụng với hiđro tạo hợp chất khí. Viết phương trình hoá học minh hoạ với brom.
Phương pháp giải
Các nguyên tố nhóm VIIA có tính chất hóa học tương tự clo.
Hướng dẫn giải
Brom tác dụng với hầu hết kim loại (trừ Au và Pt) sinh ra muối:
Br2 + 2K → 2KBr
Brom tác dụng với hiđro sinh ra sản phẩm khí hiđro bromua:
Br2 + H2 → 2HBr (k)
5. Giải bài 5 trang 101 SGK Hóa học 9
Hãy cho biết cách sắp xếp nào sau đây đúng theo chiều tính kim loại giảm dần:
a) Na, Mg, Al, K
b) K, Na, Mg, Al
c) Al, K, Na, Mg
d) Mg, K, Al, Na
Giải thích sự lựa chọn.
Phương pháp giải
Quy luật biến đổi tính kim loại và phi kim của các nguyên tố:
- Trong cùng một chu kì, theo chiều tăng dần điện tích hạt nhân, tính kim loại giảm, tính phi kim tăng.
- Trong cùng một nhóm, theo chiều tăng dần điện tích hạt nhân, tính kim loại tăng, tính phi kim giảm.
Hướng dẫn giải
Cách sắp xếp đúng là b): K, Na, Mg, Al.
Vì:
+ Na và K trong cùng một nhóm, mà điện tích hạt nhân của Na nhỏ hơn điện tích hạt nhân của K nên tính kim loại của Na < K
+ Na, Mg, Al trong cùng một chu kì, mà điện tích hạt nhân của Na < Mg < Al nên tính kim loại của Na > Mg > Al
Theo tính chất bắc cầu, tính kim loại của K > Na > Mg > Al.
6. Giải bài 6 trang 101 SGK Hóa học 9
Hãy sắp xếp các nguyên tố sau theo chiều tính phi kim tăng dần: F, O, N, P, As.
Phương pháp giải
Quy luật biến đổi tính kim loại và phi kim của các nguyên tố:
- Trong cùng một chu kì, theo chiều tăng dần điện tích hạt nhân, tính kim loại giảm, tính phi kim tăng.
- Trong cùng một nhóm, theo chiều tăng dần điện tích hạt nhân, tính kim loại tăng, tính phi kim giảm.
Hướng dẫn giải
- Chiều tính phi kim tăng từ: As, P, N, O, F.
- Giải thích:
+ N, P và As trong cùng một nhóm, mà điện tích hạt nhân của N < P < As nên tính phi kim của N > P > As
+ N, O và F trong cùng một chu kì, mà điện tích hạt nhân của N < O < F nên tính phi kim của N < O < F
→ Theo tính chất bắc cầu, tính phi kim của As < P < N < O < F.
7. Giải bài 7 trang 101 SGK Hóa học 9
a) Hãy xác định công thức của hợp chất khí A, biết rằng:
- A là oxit của lưu huỳnh chứa 50% oxi.
- 1 gam khí A chiếm thể tích là 0,35 lít ở đktc.
b) Hoà tan 12,8 gam hợp chất khí A vào 300 ml dung dịch NaOH 1,2M. Hãy cho biết muối nào thu được sau phản ứng. Tính nồng độ mol của muối (giả thiết thể tích dung dịch thay đổi không đáng kể).
Phương pháp giải
Khi dẫn SO2 vào dung dịch NaOH và SO2, có thể tạo thành muối trung hoà, muối axit hoặc cả hai muối:
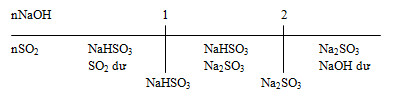
Đặt \(a = \dfrac{{{n_{NaOH}}}}{{{n_{S{O_2}}}}}\)
+ a ≤ 1: Chỉ tạo muối NaHSO3.
+ 1 ≤ a ≤ 2: Tạo 2 muối NaHSO3 và Na2SO3
+ a ≥ 2: Chỉ tạo muối Na2SO3.
Hướng dẫn giải
nA = \( \dfrac{0,35}{22,4}\) = 0,015625 mol.
MA = \( \dfrac{1}{0,015625}\) = 64g
Đặt công thức phân tử của A là SxOy
Lập tỷ số về khối lượng để tính các chỉ số x và y
\(x.\dfrac{{32}}{{64}} = \dfrac{{50}}{{100}} \to x = 1\)
\(y.\dfrac{{16}}{{64}} = \dfrac{{50}}{{100}} \to y = 2\)
Vậy công thức phân tử của A là SO2
b. \({n_{S{O_2}}} = \dfrac{{12,8}}{{64}} = 0,2\,\,mol\)
Đổi 300 ml = 0,3 lít
\({n_{NaOH}} = 1,2.0,3 = 0,36\,\,mol\)
Ta thấy \(1 < \dfrac{{{n_{NaOH}}}}{{{n_{S{O_2}}}}} = \dfrac{{0,36}}{{0,2}} = 1,8 < 2 \to \)Phản ứng tạo 2 muối Na2SO3 và NaHSO3
Phương trình phản ứng:
\(S{O_2} + NaOH \to NaH{\rm{S}}{O_3}\)(1)
x x x
\(S{O_2} + 2NaOH \to N{a_2}S{O_3} + {H_2}O\)(2)
y 2y y
Gọi \({n_{NaH{\rm{S}}{O_3}}} = x\,\,(mol);{n_{N{a_2}S{O_3}}} = y\,\,(mol)\)
Theo phương trình (1) và (2): \({n_{S{O_2}}} = {n_{NaH{\rm{S}}{O_3}}} + {n_{N{a_2}S{O_3}}} \to x + y = 0,2\)(*)
Theo phương trình (1) và (2): \({n_{NaOH}} = {n_{NaH{\rm{S}}{O_3}}} + 2{n_{N{a_2}S{O_3}}} \to x + 2y = 0,36\)(**)
Từ (*) và (**) \( \to\) x = 0,04; y = 0,16
\({C_{M(NaH{\rm{S}}{O_3})}} = \dfrac{{0,04}}{{0,3}} = 0,13M\)
\({C_{M(N{a_2}S{O_3})}} = \dfrac{{0,16}}{{0,3}} = 0,53M\)
Tham khảo thêm
- doc Giải bài tập SGK Hóa 9 Bài 25: Tính chất của phi kim
- doc Giải bài tập SGK Hóa 9 Bài 26: Clo
- doc Giải bài tập SGK Hóa 9 Bài 27: Cacbon
- doc Giải bài tập SGK Hóa 9 Bài 28: Các oxit của cacbon
- doc Giải bài tập SGK Hóa 9 Bài 29: Axit cacbonic và muối cacbonat
- doc Giải bài tập SGK Hóa 9 Bài 30: Silic và Công nghiệp silicat
- doc Giải bài tập SGK Hóa 9 Bài 32: Luyện tập chương 3 Phi kim - Sơ lược về bảng tuần hoàn các nguyên tố hóa học
