Giải bài tập SGK Hóa 9 Bài 5: Luyện tập TCHH của oxit và axit
Hướng dẫn Giải bài tập Hóa học 9 Bài 5 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập về tính chất hóa học của oxit và axit đồng thời ôn luyện tốt kiến thức. Mời các em cùng theo dõi.
Mục lục nội dung

1. Giải bài 1 trang 21 SGK Hóa 9
Có những oxit sau: SO2, CuO, Na2O, CO2. Hãy cho biết những oxit nào tác dụng được với:
a) Nước.
b) Axit clohiđric.
c) Natri hiđroxit.
Viết các phương trình hóa học.
Phương pháp giải
Với bài tập xác định oxit thích hợp, cần nắm rõ tính chất hóa học của oxit axit và oxit bazơ.
Hướng dẫn giải
Câu a: Những oxit tác dụng với nước là: SO2, Na2O, CO2
SO2 + H2O → H2SO3
Na2O + H2O → 2NaOH
CO2 + H2O → H2CO3
Câu b: Những oxit tác dụng với HCl là CuO, Na2O
CuO + 2HCl → CuCl2 + H2O
Na2O + 2HCl → 2NaCl + H2O
Câu c: Những oxit tác dụng với natri hiđroxit là SO2 và CO2
SO2 + 2NaOH → Na2SO3 + H2O
CO2 + 2NaOH → Na2CO3 + H2O
2. Giải bài 2 trang 21 SGK Hóa 9
Những oxit nào dưới đây có thể điều chế bằng
a) Phản ứng hóa hợp? Viết phương trình hóa học.
b) Phản ứng hóa hợp và phản ứng phân hủy? Viết phương trình hóa học.
(1) H2O
(2) CuO
(3) Na2O
(4) CO2
(5) P2O5
Phương pháp giải
Để biết oxit nào có thể điều chế bằng phản ứng hóa hợp hay phân hủy cần ghi nhớ:
- Phản ứng hóa hợp là phản ứng từ hai hay nhiều chất ban đầu tạ ra một chất mới.
- Phản ứng phân hủy là từ một chất ban đầu tạo ra 2 hay nhiều chất khác.
Hướng dẫn giải
Câu a: Những oxit có thể điều chế bằng phản ứng hóa hợp
Cả 5 oxit đã cho đều có thể điều chế bằng phản ứng hóa hợp, vì các nguyên tố H, Cu, Na, P đều tác dụng được với oxi.
Phương trình hóa học:
2H2 + O2 → 2H2O
2Cu + O2 → 2CuO
4Na + O2 → 2Na2O
4P + 5O2 → 2P2O5
C + O2 → CO2
Câu b: Những oxit có thể điều chế bằng phản ứng hóa hợp và phản ứng phân hủy
Các oxit Na2O, CuO, CO2, H2O có thể được điều chế bằng phản ứng hóa hợp và phân hủy:
Thí dụ:
2NaNO2 \(\xrightarrow[{}]{{{t^o}}}\) Na2O + N2 + ½ O2
4Na + O2 \(\xrightarrow[{}]{{{t^o}}}\) 2Na2O
Cu(OH)2 \(\xrightarrow[{}]{{{t^o}}}\) CuO + H2O
2Cu + O2 \(\xrightarrow[{}]{{{t^o}}}\) 2CuO
2H2 + O2 \(\xrightarrow[{}]{{{t^o}}}\) 2H2O
CaCO3 \(\xrightarrow[{}]{{{t^o}}}\) CaO + CO2
C + O2 \(\xrightarrow[{}]{{{t^o}}}\) CO2
3. Giải bài 3 trang 21 SGK Hóa 9
Khí CO được dùng làm chất đốt trong công nghiệp, có lẫn tạp chất là các khí SO2 và CO2. Làm thế nào có thể loại bỏ được những tạp chất ra khỏi CO bằng hóa chất rẻ tiền nhất?
Viết các phương trình hóa học.
Phương pháp giải
Với dạng bài tập loại bỏ tạo chất ra khỏi CO, tadùng chất có sẵn trong đời sống tác dụng với tạp chất và không tác dụng với CO để loại bỏ được các tạp chất khí này. Đó là dung dịch nước vôi trong Ca(OH)2.
Hướng dẫn giải
Để loại bỏ SO2 và CO2 ta dùng dung dịch bazơ:
- Dung dịch bazơ rẻ tiền nhất là dung dịch nước vôi trong Ca(OH)2.
- Dẫn hỗn hợp khí đi qua dung dịch Ca(OH)2 dư, toàn bộ SO2 và CO2 bị hấp thụ hết do có phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O
SO2 + Ca(OH)2 → CaSO3 + H2O
→ Khí CO không phản ứng, thoát ra và thu được.
4. Giải bài 4 trang 21 SGK Hóa 9
Cần phải điều chế một lượng muối đồng (II) sunfat. Phương pháp nào sau đây tiết kiệm được axit sunfuric?
a) Axit sunfuric tác dụng với đồng (II) oxit.
b) Axit sunfuric đặc tác dụng với kim loại đồng.
Giải thích các câu trả lời.
Phương pháp giải
Để xác định phương pháp nào tiết kiệm axit sunfuric hơn: ta so sánh số mol CuSO4 và H2SO4
Phương trình nào điều chế được nhiều CuSO4 nhất và tốn ít lượng H2SO4 hơn thì chọn phương pháp đó.
Hướng dẫn giải
Phương trình hóa học để điều chế muối đồng (II) sunfat:
a) H2SO4 + CuO → CuSO4 + H2O (1)
b) Cu + 2H2SO4(đặc) → CuSO4 + SO2↑ + 2H2O (2)
Giả sử cần điều chế a mol CuSO4
- Theo phương trình (1): nH2SO4 = nCuSO4 = a mol
- Theo phương trình (2): nH2SO4 = 2.nCuSO4 = 2a mol
Qua phản ứng (1) và (2) ta nhận thấy muốn điều chế a mol CuSO4 để tiết kiệm ta nên theo phản ứng (1) thì lượng axit H2SO4 sử dụng ít hơn ở phản ứng (2).
Vậy ta sử dụng phương pháp axit sunfuric tác dụng với đồng (II) oxit tiết kiệm được axit sunfuric hơn.
5. Giải bài 5 trang 21 SGK Hóa 9
Hãy thực hiện những chuyển đổi hóa học sau bằng cách viết những phương trình hóa học?
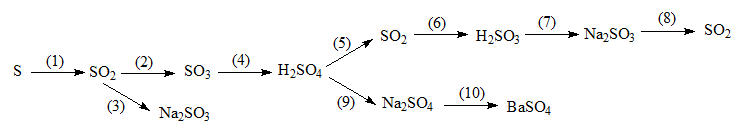
Phương pháp giải
Để viết phương trình hóa học của chuỗi chuyển hóa trên cần nắm được tính chất hóa học của lưu huỳnh, axit và các chất có trong dãy. Từ chất đầu và chất cuối để xác định các chất còn lại trong phương trình.
Hướng dẫn giải
Phương trình hóa học của dãy chuyển hóa trên:
(1) S + O2 \(\xrightarrow[{}]{{{t^o}}}\) SO2
(2) 2SO2 + O2 \(\xrightarrow[{{V_2}{O_5}}]{{{t^o}}}\) 2SO3
(3) SO2 + Na2 O → Na2SO3
(4) SO3 +H2O → H2SO4
(5) 2H2SO4 (đ) + Cu \(\xrightarrow[{}]{{{t^o}}}\) CuSO4 + SO2↑ +2 H2O
(6) SO2 + H2O → H2SO3
(7) H2SO3 + 2 NaOH → Na2SO3 + 2H2O
(8) Na2SO3 + 2HCl → 2 NaCl + SO2 ↑ + H2O
(9) H2SO4 + 2 NaOH → Na2SO4 + 2H2O
(10) NaSO4 + BaCl2 → BaSO4 ↓ + 2NaCl
Tham khảo thêm
- docx Giải bài tập SGK Hóa 9 Bài 1: Tính chất HH của oxit và Khái quát về sự PL oxit
- docx Giải bài tập SGK Hóa 9 Bài 2: Một số oxit quan trọng
- docx Giải bài tập SGK Hóa 9 Bài 3: Tính chất hóa học của axit
- docx Giải bài tập SGK Hóa 9 Bài 4: Một số axit quan trọng
- docx Giải bài tập SGK Hóa 9 Bài 7: Tính chất hóa học của bazơ
- docx Giải bài tập SGK Hóa 9 Bài 8: Một số bazơ quan trọng
- docx Giải bài tập SGK Hóa 9 Bài 9: Tính chất hóa học của muối
- docx Giải bài tập SGK Hóa 9 Bài 10: Một số muối quan trọng
- docx Giải bài tập SGK Hóa 9 Bài 11: Phân bón hóa học
- docx Giải bài tập SGK Hóa 9 Bài 12: Mối quan hệ giữa các loại hợp chất vô cơ
- docx Giải bài tập SGK Hóa 9 Bài 13: Luyện tập chương 1 Các loại hợp chất vô cơ
