Hoá học 10 Bài 1: Thành phần nguyên tử
Nội dung bài học trình bày các thí nghiệm tìm ra electron, hạt nhân, proton, nơtron và cụ thể đặc điểm các loại hạt trong nguyên tử: Điện tích, khối lượng...
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Thành phần cấu tạo của nguyên tử
a. Electron
Sự tìm ra electron
- Năm 1897, J.J. Thomson (Tôm-xơn, người Anh ) đã tìm ra tia âm cực gồm những hạt nhỏ gọi là electron(e).
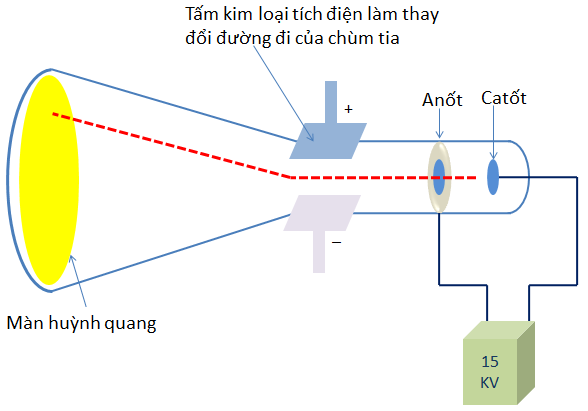
Kết luận:
- Tia âm cực là chùm hạt vật chất có khối lượng và chuyển động với vận tốc rất lớn.
- Tia âm cực là chùm hạt mang điện âm,phát ra từ cực âm ,các hạt tạo thành tia âm cực được gọi là các electron (ký hiệu là e).
- Electron có mặt ở mọi chất, electron tạo nên lớp vỏ nguyên tử của mọi nguyên tố hóa học.
- Tia âm cực bị lệch trong từ trường và mang điện tích âm.
b. Khối lượng, điện tích electron
me = 9,1094.10-31kg.
qe = -1,602.10-19 C (coulomb) = -1 (đvđt âm, kí hiệu là – e0).
c. Cấu tạo hạt nhân nguyên tử
- Năm 1911, nhà vật lí người Anh Rutherford và các cộng sự cho các hạt a bắn phá một lá vàng mỏng.
- Từ đó nhận thấy nguyên tử có đặc điểm:
+ Cấu tạo rỗng
+ Chứa phần mang điện tích dương, được gọi là hạt nhân
+ Kích thước của hạt nhân rất nhỏ so với kích thước của nguyên tử
- Các em chú ý quan sát mô phỏng thí nghiệm tìm ra electron trong đoạn phim sau đây:
Video 1: Thí nghiệm phát hiện ra hạt nhân nguyên tử
- Kết luận:
+ Nguyên tử cấu tạo gồm hạt nhân và lớp vỏ nguyên tử (chứa các electron).
+ Do nguyên tử trung hòa về điện nên số đơn vị điện tích dương của hạt nhân bằng đúng số electron quay xung quanh hạt nhân.
+ Khối lượng nguyên tử xấp xỉ khối lượng hạt nhân.
d. Cấu tạo của hạt nhân nguyên tử
Sự tìm ra hạt proton.
- Năm 1918, hạt proton được tìm ra có:
+ Khối lượng: mp = 1,6726.10-27 kg
+ Điện tích: qp = + 1,6.10-19 C = e0
- Hạt proton là một thành phần cấu tạo của hạt nhân nguyên tử. Quy ước: 1+
Sự tìm ra hạt nơtron
- Năm 1932, Chadwick tìm ra hạt nơtron có:
+ Khối lượng: mn = mp = 1,6748.10-27 kg
+ Điện tích: qn = 0
- Hạt notron là một thành phần cấu tạo của hạt nhân nguyên tử.
1.2. Kích thước và khối lượng nguyên tử
a. Kích thước
- Để biểu thị kích thước nguyên tử người ta dùng đơn vị nanomet(nm) hay angstrom Å
1 nm = 10-9m ; 1 Å = 10-10m ; 1nm = 10Å
- Nguyên tử nhỏ nhất là nguyên tử Hidro có bán kính khoảng 0,053 nm
- Đường kính của hạt nhân nguyên tử còn nhỏ hơn (vào khoảng 10-5 nm)
- Đường kính của electron và proton còn nhỏ hơn nhiều ( vào khoảng 10-8 nm)
b. Khối lượng nguyên tử
- Do khối lượng thật của 1 nguyên tử quá bé, người ta dùng đơn vị khối lượng nguyên tử u (đvC).
1 u = 1/12 khối lượng 1 nguyên tử đồng vị cacbon 12 = 1,6605.10-27kg.
- m nguyên tử = mP + mN (Bỏ qua me)

2. Bài tập minh họa
2.1. Dạng 1: Bài tập về thành phần của nguyên tử
Bài 1: Phát biểu nào sau đây không đúng?
A. Nguyên tử được cấu tạo từ các hạt cơ bản là p, n, e.
B. Nguyên tử có cấu trúc đặc khít, gồm vỏ nguyên tử và hạt nhân nguyên tử.
C. Hạt nhân nguyên tử cấu tạo bởi các hạt proton và hạt nơtron.
D. Vỏ nguyên tử được cấu tạo từ các hạt electron.
Hướng dẫn giải
⇒ Đáp án D
Bài 2: Nguyên tố hóa học bao gồm các nguyên tử:
A. Có cùng số khối A
B. Có cùng số proton
C. Có cùng số nơtron
D. Có cùng số proton và số nơtron
Hướng dẫn giải
⇒ Đáp án B
2.2. Dạng 2: Cách xác định nguyên tố dựa vào số hạt
a) Dạng toán cơ bản cho 1 nguyên tử
Tổng số hạt cơ bản của 1 nguyên tử X là 82, trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 22. Vậy X là
Hướng dẫn giải
Ta có: 2.Z + N =82
→ 2.Z - N=22
→ Z = (82+22)/4 =26
→ X là Fe
Công thức áp dụng nhanh: Z = (S + A )/4
Trong đó:
Z: số hiệu nguyên tử
S: tổng số hạt
A: Hiệu số hạt mang điện và không mang điện
b) Dạng toán áp dụng cho hỗn hợp các nguyên tử
Bài 1: Tổng số hạt cơ bản trong phân tử X có công thức là M2O là 140, trong phân tử X thì tổng số hạt mang điện nhiều hơn số hạt không mang điện là 44. Vậy X là
Hướng dẫn giải
Trong X có 2 nguyên tử M và 1 nguyên tử O.
Nên ta có : 2.ZM + 8 = (140 + 44) : 4 = 46 ⇒ Z =19
⇒ M là K ⇒ X là K2O
Áp dụng mở rộng công thức trên trong giải ion
Nếu ion là Xx+ thì ZX = (S + A+ 2x) / 4
Nếu ion Yy- thì ZY = (S + A – 2y) / 4
Vậy khác biệt của công thức này với công thức ban đầu đó là thêm giá trị của điện ion
Cách nhớ: nếu ion dương thì đem +2 lần giá trị điện ion dương, nếu âm thì –2 lần giá trị điện ion âm)
Bài 2: Tổng số hạt cơ bản của ion M3+ là 79, trong đó tổng số hạt mang điện nhiều hơn không mang điện là 19. M là
Hướng dẫn giải
ZM = (79 + 19 +2.3) : 4 = 26 ⇒ M là sắt (Fe).
c) Dạng toán cho tổng số hạt cơ bản
Tổng số hạt cơ bản của nguyên tử X là 52, X thuộc nhóm VIIA. X là
Hướng dẫn giải
Z ≤ 52: 3 = 17,33 ⇒ Z là Clo (Cl)
ZM ≤ 60:3 = 20 ⇒ Ca, ZX ≤ 24 : 3 = 8 ⇒ O Vậy MX là CaO.
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Bán kính nguyên tử và khối lượng mol nguyên tử Fe lần lượt là 1,28 Ăngstrong và 56 g/mol .Tính khối lượng riêng của Fe, biết rằng trong tinh thể, các nguyên tử Fe chiếm 74% thể tích, phần còn lại là rỗng?
Câu 2: Nguyên tử Au có bán kính và khối lượng mol nguyên tử lần lượt là 1,44A và 197 g/mol. biết khối lượng riêng của Au là 19,36g /cm3 Hỏi các nguyên tử Au chiếm bao nhiêu phần trăm trong tinh thể?
Câu 3: Nguyên tử vàng có 79 electron ở vỏ nguyên tử. Điện tích hạt nhân của nguyên tử vàng là?
Câu 4: Một nguyên tử có 12 proton và 12 nơtron trong hạt nhân. Điện tích của ion tạo thành khi nguyên tử này bị mất 2 electron là?
Câu 5: Tưởng tượng ta có thể phóng đại hạt nhân thành một quả bóng bàn có đường kính 4 cm thì đường kính của nguyên tử là bao nhiêu? Biết rằng đường kính của nguyên tử lớn hơn đường kính của hạt nhân khoảng 104 lần?
3.2. Bài tập trắc nghiệm
Câu 1: Nguyên tử X có 26 proton trong hạt nhân.
Cho các phát biểu sau về X:
X có 26 nơtron trong hạt nhân
X có 26 electron ở vỏ nguyên tử
X có điện tích hạt nhân là 26+
Khối lượng nguyên tử X là 26u
Trong các phát biểu trên, số phát biểu đúng là
A. 1
B. 2
C. 3
D. 4
Câu 2: Một nguyên tử chỉ có 1 electron ở vỏ nguyên tử và hạt nhân nguyên tử có khối lượng là 5,01.10-24 gam. Số hạt proton và hạt nowtron trong hạt nhân nguyên tử này lần lượt là
A. 1 và 0
B. 1 và 2
C. 1 và 3
D. 3 và 0
Câu 3: Cho biết nguyên tử crom có khối lượng 52u, bán kính nguyên tử này bằng 1,28 Å.
a) Khối lượng riêng của nguyên tử crom là
A. 2,47 g/cm3
B. 9,89 g/cm3
C. 5,20 g/cm3
D. 5,92 g/cm3
b) Coi khối lượng của nguyên tử tập trung trong hạt nhân. Khối lượng riêng của hạt nhân nguyên tử crom là
A. 2,31.1011 kg/cm3
B. 1,38.1014 kg/cm3
C. 2,89.1010 kg/cm3
D. 2,31.1013 kg/cm3
Câu 4: Bắn một chùm tia α đâm xuyên qua một mảnh kim loại. hỏi khi một hạt nhân bị bắn phá, có khoảng bao nhiêu hạt α đã đi xuyên qua nguyên tử? biết rằng đường kính nguyên tử lớn hơn đường kính của hạt nhân khoảng 104 lần.
A. 106
B. 107
C. 108
D. 109
Câu 5: Trong nguyên tử, loại hạt nào có khối lượng không đáng kể so với các hạt còn lại ?
A. proton
B. nơtron
C. electron
D. nơtron và electron
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Thành phần nguyên tử Hóa học 10 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Thí nghiệm tìm ra electron, hạt nhân, proton, nơtron
- Đặc điểm các loại hạt trong nguyên tử: Điện tích, khối lượng...
