Hoá học 10 Bài 39: Luyện tập Tốc độ phản ứng và cân bằng hóa học
Nhằm củng cố kiến thức về tốc độ phản ứng và cân bằng hóa học, sự vận dụng nguyên lí Lơ Sa - tơ - đi - ê để giải thích sự chuyển dịch cân bằng. eLib xin chia sẻ với các bạn bài 39: Luyện tập: Tốc độ phản ứng và cân bằng hóa học . Với lý thuyết và các bài tập có lời giải chi tiết, hi vọng rằng đây sẽ là tài liệu giúp các bạn học tập tốt hơn.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Định nghĩa
Tốc độ phản ứng là độ biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian
Cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch
1.2. Các yếu tố Ảnh hưởng đến Tốc độ phản ứng và Cân bằng hóa học
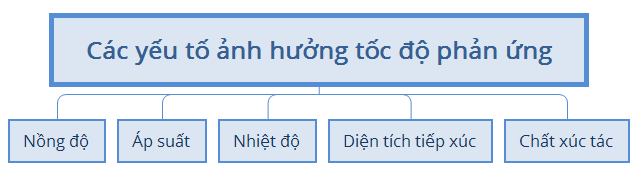
a. Tốc độ phản ứng
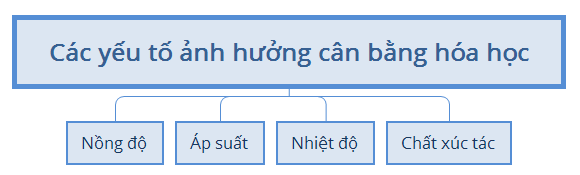
b. Cân bằng hóa học
1.3. Nguyên lí chuyển dịch cân bằng Lơ- sa-tơ-li-ê
Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài như sự biến đổi nồng độ, nhiệt độ, áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
2. Bài tập minh họa
2.1. Dạng 1: Tính tốc độ phản ứng
Cho phản ứng hóa học: A + B → C
Nồng độ ban đầu của A là 1 mol/l, của B là 0,8 mol/l. Sau 10 phút, nồng độ của B chỉ còn 20% nồng độ ban đầu. Tốc độ trung bình của phản ứng là
A. 0,16 mol/l.phút
B. 0,016 mol/l/phút
C. 1,6 mol/l.phút
D. 0,064 mol/l.phút
Hướng dẫn giải
CB sau = 0,8.20% = 0,16 (mol/l)
\({\overline v _B} = \frac{{0,8 - 0,16}}{{10}} = 0,064\) mol/l.phút
Vì hệ số của B là 1 \( \to \overline v = {\overline v _B}\) = mol/l.phút
⇒ Đáp án D
2.2. Dạng 2: Xác định nồng độ chất ban đầu hoặc sản phẩm
Bài 1: Người ta cho N2 và H2 vào trong bình kín dung tích không đổi và thực hiện phản ứng
N2 (k) + 3H2 (k) ↔ 2NH3 (k)
Sau một thời gian, nồng độ các chất trong bình như sau: [N2] = 2M; [H2] = 3M; [NH3] = 2M. Nồng độ mol/l của N2 và H2 ban đầu lần lượt là :
A. 3 và 6.
B. 2 và 3.
C. 4 và 8.
D. 2 và 4.
Hướng dẫn giải
Do ban đầu chỉ có N2, H2 nên lượng NH3 trong hỗn hợp sau là sản phẩm được sinh ra trong phản ứng N2 và H2 → từ nồng độ của NH3 xác định được nồng độ phản ứng của H2 và N2.
N2 (k) + 3H2 (k) ↔ 2NH3 (k)
Bđ (C0): x y
Pư: 1M ← 3M ← 2M
Cb: 2M 3M 2M
Ta có: C0N2 = CCB + Cpư ⇒ x = 2 + 1 = 3(M)
C0 H2 = CCB + Cpư = 3 + 3 = 6 (M)
⇒ Đáp án A
Bài 2: Trong công nghiệp người ta điều chế NH3 theo phương trình hoá học:
N2 (k) + 3H2 (k) ↔ 2NH3 (k)
Khi tăng nồng độ H2 lên hai lần (giữ nguyên nồng độ của N2 và nhiệt độ phản ứng) thì tốc độ phản ứng tăng lên bao nhiêu lần?
A. 2 lần
B. 4 lần
C. 8 lần
D. 16 lần
Hướng dẫn giải
Giả sử ban đầu [N2] = aM. [H2] = bM
Tốc độ phản ứng ban đầu: v1 = k[N2][H2]3 = k.a.b3
Tốc độ phản ứng lúc sau: v2 = k[N2][H2]3 = k.a.(2b)3 = 8 k.a.b3
⇒v2 = 8 v1.
⇒ Đáp án C
2.3. Dạng 3: Mối liên hệ giữa diện tích tiếp xúc và tốc độ phản ứng
Bài 1: Nếu chia một mẩu đá vôi hình cầu có thể tích 10,00 cm3 thành tám mẩu đá vôi hình cầu thể tích bằng 1,25 cm3 thì tổng điện tích mặt cầu tăng bao nhiêu lần:
A. 2 lần
B. 4 lần
C. 8 lần
D. 16 lần
Hướng dẫn giải
- Các mẩu đá vôi là hình cầu nên :
Diện tích bề mặt tiếp xúc là:
\(S = 4\pi {R^3} \to {S^3} = {(4\pi )^3}{R^6}\)
Thể tích là :
\(V = \frac{4}{3}\pi {R^3} \to {V^2} = {(\frac{4}{3}\pi )^2}{R^6}\)
\( \to \frac{{{S^3}}}{{{V^2}}} = 12\pi \to S = \sqrt[3]{{12\pi {V^2}}}\)
- Mẩu đá vôi ban đầu có: \({S_1} = \sqrt[3]{{12\pi {V_1}^2}}\)
Mẩu đá vôi sau khi chia nhỏ có: \({S_2} = \sqrt[3]{{12\pi {V_2}^2}}\)
- Tỉ lệ diện tích bề mặt sau khi chia thành 8 mẩu đá vôi là:
\(\frac{{8{S_2}}}{{{S_1}}} = 8\sqrt[3]{{\frac{{12\pi {V_2}^2}}{{12\pi {V_1}^2}}}} = 8\sqrt[3]{{\frac{{1,{{25}^2}}}{{{{10}^2}}}}} = 2\)
⇒ Diện tích bề mặt tăng 2 lần
⇒ Đáp án A
2.4. Dạng 4: Xác định nồng độ, áp suất tại thời điểm cân bằng
Người ta tiến hành phản ứng: PC15 ⇋ PC13 + Cl2 trong một bình kín có dung tích không đổi ở nhiệt độ xác định. Nếu cho vào bình 0,5 mol PCl5 thì áp suất đầu là 1,5 atm. Khi cân bằng được thiết lập, áp suất đo được bằng 1,75 atm
a) Tính độ phân li và áp suất riêng của từng cấu tử.
b) Thiết lập biểu thức liên hệ giữa độ phân li và áp suất chung của hệ.
Hướng dẫn giải
Cân bằng: PCl5 ⇋ PCl3 + Cl2 (1)
Ban đầu: x
Phản ứng: αx αx αx
Cân bằng: x(1 – α) αx αx
Tổng số mol hỗn hợp khí tại thời điểm cân bằng: n= x (1 + α)
Trong cùng điều kiện nhiệt độ, thể tích hỗn hợp phản ứng không đổi nên tỉ số mol bằng tỉ lệ áp suất.
Vậy ta có: \(\frac{{{P_S}}}{{{P_T}}} = \frac{{x(1 + \alpha )}}{x} = \frac{{1,75}}{{1,5}} \to \alpha = 0,167\)
Áp suất riêng phần của PCl5: \({P_{PC{l_5}}} = \frac{{x(1 - \alpha )}}{{x(1 + \alpha )}}.P = 1,25atm\)
Áp suất riêng phần của PCl3 = áp suất riêng phần của Cl2:
\(\frac{{x\alpha }}{{x(1 + \alpha )}}.P = 0,25atm\)
b) Theo cân bằng (1) trong hệ có thể tích và nhiệt độ không đổi thì:
PS = PT × (1 + α)
2.5. Dạng 5: Xác định sư chuyển dịch cân bằng
Xét cân bằng sau trong một bình kín:
CaCO3(rắn) ↔ CaO(rắn) + CO2(khí) ΔH=178kJ
Ở 820oc hằng số cân bằng KC = 4,28.10-3.
a. Phản ứng trên là phản ứng tỏa nhiệt hay thu nhiệt ?
b. Khi phản ứng đang ở trạng thái cân bằng, nếu biến đổi một trong những điều kiện sau đây thì hằng số cân bằng KC biến đổi như thê nào? Giải thích.
+ Giảm nhiệt độ của phản ứng xuống.
+ Thêm khi CO2 vào.
+ Tăng dung tích của bình phản ứng lên.
+ Lấy bớt một lượng CaCO3 ra.
Hướng dẫn giải
Phản ứng: CaCO3(rắn) ↔ CaO2 + CO2(khí) ΔH=178kJ
a. Phản ứng thu nhiệt vì ΔH> 0
b. KC = [CO2]
+ Khi giảm nhiệt độ của phản ứng xuống thì cân bằng sẽ chuyển dịch theo chiều nghịch (chiều tỏa nhiệt) để đến trạng thái cân bằng mới và ở trạng thái cân bằng mới này thì nồng độ CO2 giảm ⇒ KC giảm +) Khi thêm khí CO2 vào ⇒ Nồng độ CO2 tăng ⇒ Cân bằng chuyển dịch theo chiều nghịch nhưng ở trạng thái cân bằng mới nồng độ CO2 không thay đổi KC không đổi.
+ Khi tăng dung tích của bình phản ứng lên ⇒ Áp suất của hệ giảm (nồng độ CO2 giảm) ⇒ Cân bằng chuyển dịch theo chiều thuận làm tăng nồng độ CO2 nhưng chỉ tăng đến khi nồng độ CO2 trước khi dung tích của bình lên thì dừng lại và cân bằng thiết lập ⇒ KC không đổi.
+ Lấy bớt một lượng CaCO3 ra thì hệ cân bằng không chuyển dịch ⇒ KC không đổi.
2.6. Dạng 6: Xác định hằng số cân bằng
Nồng độ ban đầu của H2 và I2 đều là 0,03 mol/l. Khi đạt đến cân bằng, nồng độ của HI là 0,04 mol/l
a. Tính nồng độ cân bằng của H2 và I2
b. Tính nồng độ cân bằng K của phản ứng tổng hợp HI
Hướng dẫn giải
Nồng độ của H2 và I2 ban đầu đề là 0,03 mol/l. Chúng phản ứng với nhau theo
phương trình:
H2 + I2 → 2HI
a. Lúc cân bằng: Nồng độ HI là 0,04mol/l. Như vậy đã có:
0,04 : 2 = 0,02 mol/l phản ứng với 0,02 mol/l I2
⇒ Nồng độ cân bằng của H2 và I2 là:
[H2]=[I2]=0,03 – 0,02 =0,01 (mol/l)
b. Hằng số cân bằng K của phản ứng tổng hợp HI.
c. KC = \(\frac{{{{[HI]}^2}}}{{[{H_2}].[{I_2}]}} = \frac{{{{(0,04)}^2}}}{{0,01.0,01}} = 16\)
3. Luyện tập
3.1 Bài tập tự luận
Câu 1: Cho phản ứng hóa học: A + B → C
Nồng độ ban đầu của A là 1 mol/l, của B là 0,8 mol/l. Sau 10 phút, nồng độ của B chỉ còn 20% nồng độ ban đầu. Tốc độ trung bình của phản ứng là?
Câu 2: Cân bằng phản ứng H2 + I2 ⇆ 2HI (ΔH < 0) được thiết lập ở toC khi nồng độ các chất ở trạng thái cân bằng là [H2] = 0,8 mol/l; [I2] = 0,6 mol/l; [HI] = 0,96 mol/l. Hằng số K có giá trị là?
Câu 3: Trong bình kín dung tích 1 lít, người ta cho vào 5,6 gam khí CO và 5,4 gam hơi nước. Phản ứng xảy ra là: CO + H2O ⇆ CO2 + H2. Ở 850oC hằng số cân bằng của phản ứng trên là 1. Nồng độ mol của CO và H2O khi đạt đến cân bằng lần lượt là?
Câu 4: Xét cân bằng: N2O4 (k) ⇆ 2NO2 (k) ở 25oC. Khi chuyển dịch sang một trạng thái cân bằng mới nếu nồng độ của N2O4 tăng lên 9 lần thì nồng độ của NO2?
3.2. Bài tập trắc nghiệm
Câu 1: Đối với một hệ ở trạng thái cân bằng, nếu thêm vào chất xúc tác thì
A. chỉ làm tăng tốc độ phản ứng thuận
B. chỉ làm tăng tốc dộ phản ứng nghịch
C. làm tăng tốc độ phản ứng thuận và nghịch với số lần như nhau
D. không làm tăng tốc độ của phản ứng thuận và nghịch
Câu 2: Xét phản ứng trong quá trình luyện gang:
Fe2O3 (r) + 3CO (kk) ⇌ 2Fe (r) + 3CO2 (k); ΔH > 0
Có các biện pháp:
(1) Tăng nhiệt đô phản ứng
(2) Tăng áp suất chung của hệ
(3) Giảm nhiệt độ phản ứng
(4) Tăng áp suất CO
Trong các biện pháp trên, có bao nhiêu biện pháp làm tăng hiệu suất của phản ứng?
A. 1
B. 2
C. 3
D. 4
Câu 3: Trong các phát biểu sau, phát biểu nào phù hợp với một phản ứng thuận nghịch ở trạng thái cân bằng?
A. Phản ứng thuận đã kết thúc
B. Phản ứng nghịch đã kết thúc
C. Cả phản ứng thuận và phản ứng nghịch đã kết thúc
D. Tốc độ phản ứng thuận bằng tốc dộ phản ứng nghịch
Câu 4: Xét phản ứng: 2NO2 (k) ⇆ N2O4 (k). Tỉ khối hơi của hỗn hợp khí thu được so với H2 ở nhiệt độ t1 là 27,6; ở nhiệt độ t2 là 34,5 (t1 > t2). Có 3 ống nghiệm đựng khí NO2 (có nút kín). Sau đó: Ngâm ống thứ nhất vào cốc nước đá; ngâm ống thứ hai vào cốc nước sôi; ống thứ ba để ở điều kiện thường. Một thời gian sau, ta thấy:
A. ống thứ nhất có màu đậm nhất, ống thứ hai có màu nhạt nhất.
B. ống thứ nhất có màu nhạt nhất, ống thứ hai có màu đậm nhất.
C. ống thứ nhất có màu đậm nhất, ống thứ ba có màu nhạt nhất.
D. ống thứ nhất có màu đậm nhất, ống thứ hai và ống thứ ba đều có màu nhạt hơn.
Câu 5: Cho các cân bằng sau:
(1) 2SO2 (k) + O2 (k) ⇆ 2SO3 (k)
(2) N2 (k) + 3H2 (k) ⇆ 2NH3 (k)
(3) CO2 (k) + H2 (k) ⇆ CO (k) + H2O (k)
(4) 2HI (k) ⇆ H2 (k) + I2 (k)
(5) CH3COOH (l) + C2H5OH (l) ⇆ CH3COOC2H5 (l) + H2O (l)
Khi thay đổi áp suất, nhóm gồm các cân bằng hoá học đều không bị chuyển dịch là:
A. (1) và (2).
B. (3) và (4).
C. (3), (4) và (5).
D. (2), (4) và (5).
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Luyện tập Tốc độ phản ứng và cân bằng hóa học Hóa học 10 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Tốc độ phản ứng và cân bằng hóa học
- Rèn luyện việc vận dụng nguyên lí Lơ-sa-tơ-li-ê cho các cân bằng hóa học.
