Hoá học 10 Bài 23: Hiđro clorua - Axit clohiđric và muối clorua
Axit clohidric có đầy đủ tính chất của một axit hay không? Nó có những tính chất nào khác so với các axit thông thường? Nhận biết ion Cl- bằng cách nào? Chúng ta cùng nhau tìm hiểu nội dung bài giảng Hiđro clorua - Axit clohiđric và muối clorua để làm rõ các vấn đề nêu trên.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Hidro clorua - Axit clohidric
a. Hydroclorua
- Cấu tạo phân tử
+ Cặp electron bị lệch về phía clo vì clo có độ âm điện lớn hơn hydro.
+ Công thức electron: 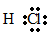
- Tính chất
+ Hyđroclorua là chất khí, không màu, tan nhiều trong nước (1lít nước hòa tan 500 lít HCl)
+ Hyđroclorua nặng hơn không khí
+ Khí HCl không làm quì tim (khô) hóa đỏ
+ Khí HCl không tác dụng với CaCO3,...
Video 1: Khí HCl tan trong nước
Lí giải vì sao nước lại phun vào bình là do khí Hidroclorua tan nhiều trong nước tạo ra sự giảm mạnh áp suất trong bình, áp suất của khí quyển đẩy nước vào thế chỗ khí HCl đã hòa tan.
Dung dịch thu được là axit nên làm dung dịch quỳ tím ngả sang màu đỏ. Vậy, khí HCl tan rất nhiều trong nước. Người ta xác định được ở 200C, một thể tích nước có thể hòa tan tới gần 500 thể tích khí HCl.
b. Axit clohiđric
- Tính chất vật lí
+ Axit clohiđric là chất lỏng không màu, mùi xốc.
+ HCl đặc C% ≈ 37% và D = 1,19(g/ml)
+ HCl đặc bốc khối trong không khí ẩm.
- Tính chất hóa học
Axit clohiđric là axit mạnh có đầy đủ tính chất của một axit: là làm đổi màu quỳ, tác dụng với kim loại đứng trước Hidro, tác dụng với bazơ, oxit bazơ tạo muối + nước và tác dụng được với muối.
Ví dụ:
2HCl + Fe → FeCl2 + H2
2HCl + CuO → CuCl2 + H2O
2HCl + Fe(OH)2 → FeCl2 + H2O
2HCl + Na2CO3 → 2NaCl + CO2 + H2O
HCl + AgNO3 → HNO3 + AgCl
Axit clohiđric có tính khử:
Do trong phân tử HCl, nguyên tố clo có số oxi hóa thấp nhất (-1). Khi dung dịch HCl đặc tác dụng với chất oxi hóa mạnh như MnO2, KMnO4 ... thì HCl bị oxi hóa thành Cl2.
Ví dụ:
PbO2 + 4HCl → PbCl2 + Cl2 + 2H2O
MnO2 + HCl → MnCl2 + Cl2 + 2H2O
c. Điều chế
- Trong phòng thí nghiệm
NaCl + H2SO4 → NaHSO4 + HCl
NaCl + H2SO4 → Na2SO4 + 2HCl
Video 2: Điều chế HCl
- Trong công nghiệp
Trong công nghiêp (phương pháp tổng hợp) đốt Cl2 và H2 lấy từ phương trình điện phân dung dịch NaCl
H2 + Cl2 → 2HCl
NaCl + H2SO4 → Na2SO4 + 2HCl
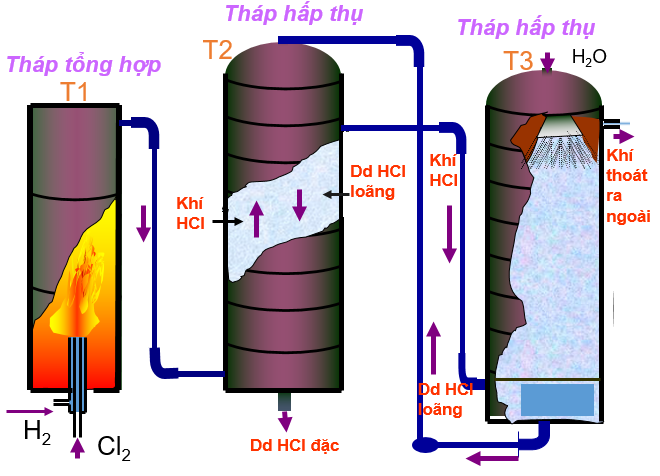
Clo hóa các hợp chất hữu cơ đặc biệt là hyđrocacbon.
C2H6 + Cl2 → C2H5Cl + HCl
1.2. Muối clorua và nhận biết muối clorua
a. Một số muối clorua
Ví dụ:
NaCl: làm muối ăn
ZnCl2: dùng làm chất chống mục;
BaCl2: thuốc trừ sâu;
KCl: phân bón;
Đa số các muối clorua tan nhiều trong nước, trừ AgCl không tan, ít tan:CuCl, PbCl2
Ứng dụng quan trọng nhất là muối NaCl. Ngoài việc làm muối ăn và bảo quản thực phẩm, NaCl còn là nguyên liệu quan trọng đối với ngành công nghiệp hóa chất để điều chế Cl2, H2, NaOH, nước Javen...
b. Nhận biết ion clorua
Thuốc thử: dd AgNO3
Phương pháp: cho vài giọt dd AgNO3 vào dung dịch cần phân biệt nếu có thấy xuất hiện kết tủa không tan trong axit mạnh → HCl hoặc muối clorua.
AgNO3 + HCl → AgCl ↓+ HNO3
AgNO3 + NaCl → AgCl ↓ + NaNO3
Video 3: Nhận biết ion Clorua (Cl-)
2. Bài tập minh họa
2.1. Dạng 1: Lý thuyết về axit clohidic
Bài 1: Khí HCl khô khi gặp quỳ tím thì làm quỳ tím
A. chuyển sang màu đỏ.
B. chuyển sang màu xanh.
C. không chuyển màu.
D. chuyển sang không màu.
Hướng dẫn giải
Khí HCl khô không làm quỳ tím đổi màu.
Đáp án C.
Bài 2: Cho các phản ứng sau
(a) 4HCl + PbO2 → PbCl2 + Cl2 + 2H2O
(b) HCl + NH4HCO3 → NH4Cl + CO2 + H2O
(c) 2HCl + 2HNO3 → 2NO2 + Cl2 + 2H2O
(d) 2HCl + Zn → ZnCl2 + H2
Số phản ứng trong đó HCl thể hiện tính khử là:
A. 2.
B. 4.
C. 1.
D. 3.
Hướng dẫn giải
HCl thể hiện tính khử khi số OXH của HCl tăng sau phản ứng gồm các phản ứng (a) và (c) đều có nguyên tố Clo có số OXH tăng từ -1 lên 0
Đáp án A
2.2. Dạng 2: Bài toán HCl tác dụng với kim loại
Bài 1: Cho 44,5 gam hỗn hợp bột Zn, Mg tác dụng với dung dịch HCl dư thấy có 22,4 lít khí H2 bay ra (đktc). Khối lượng muối clorua tạo ra trong dung dịch là:
A. 80.
B. 115,5.
C. 51,6.
D. 117,5.
Hướng dẫn giải
n H2 = 22,4: 22,4 = 1 mol
n HCl = 2 n H2 = 2 mol
Áp dụng định luật bảo toàn khối lượng ta có:
m KL + m HCl = m Muối + m H2
m Muối = 44,5 + 2.36,5 – 1.2 = 115,5 gam
Đáp án B
Bài 2: Cho 10,3 gam hỗn hợp Cu, Al, Fe vào dung dịch HCl thu được 5,6 lít khí (đktc) và 2 gam chất rắn không tan. Vậy % theo khối lượng của từng chất trong hỗn hợp ban đầu lần lượt là:
A. 26%, 54%, 20%.
B. 20%, 55%, 25%.
C. 19,4%, 50%, 30,6%.
D. 19,4%, 26,2%, 54,4%.
Hướng dẫn giải
Cu không tác dụng với HCl → m Cu = 2 gam
→ m Al + m Fe = 8,3 gam (1)
nH2 = 5,6: 22,4 = 0,25 mol
Gọi n Al, n Fe lần lượt là x, y mol
Từ (1) → 27x + 56y = 8,3 (I)
Áp dụng định luật bảo toàn electron
Tổng e nhường = tổng e nhận
Al →Al+3 + 3e
x 3x
Fe → Fe+2 + 2e
y 2y
2H+ + 2e → H2
0,5 0,25
→ 3x + 2y = 0,5 (II)
Từ (I) và (II) → x = y = 0,1 mol
%mAl = 0,1. 27: 10,3.100% = 26,21%
%mCu = 2: 10,3.100% = 19,41%
%mFe = 54,4%
Đáp án D
2.3. Dạng 3: Bài toán HCl tác dụng với oxit kim loại, muối cacbonat
Bài 1: Cho 37,6 gam hỗn hợp gồm CaO, CuO và Fe2O3 tác dụng vừa đủ với 0,6 lít dung dịch HCl 2M, rồi cô cạn dung dịch sau phản ứng thì số gam muối khan thu được là:
A. 70,6.
B. 61,0.
C. 80,2.
D. 49,3.
Hướng dẫn giải
nHCl = 0,6. 2 = 1,2 (mol)
→ nH2O sinh ra sau phản ứng = ½ n HCl = 0,6 mol
Áp dụng định luật bảo toàn khối lượng ta có:
m oxit + mHCl = m Muối + m H2O
→ m Muối = 37,6 + 1,2.36,5 – 0,6.18 = 70,6 gam
Đáp án A
Bài 2: Hoà tan hoàn toàn 10,05 gam hỗn hợp 2 muối cacbonat kim loại hoá trị II và III vào dung dịch HCl thu được dung dịch A và 0,672 lít khí (đktc). Khối lượng muối trong A là:
A. 10,38 gam.
B. 20,66 gam.
C. 30,99 gam.
D. 9,32 gam.
Hướng dẫn giải
nCO2 = 0,672: 22,4 = 0,03 mol
→ n CO3 = n CO2 = 0,03 mol
Ta có phương trình tổng quát
M2(CO3)n + 2nHCl → 2MCln + nCO2 + nH2O
Ta nhận thấy khi muối cacbonat tác dụng với HCl
1 mol CO3 bị thế băng 2 mol Cl khiến khối lượng tăng lên: 2.35,5 – 60 = 11 gam
→ 0,03 mol CO3 bị thế bằng 0,06 mol Cl khiến khối lượng muối tăng lên là:
0,06.35,5 – 0,03.60 = 0,33 gam
→ m muối = 10,05 + 0,33 = 10,38 gam
Đáp án A
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Hòa tan 12,8 gam hỗn hợp gồm Fe, FeO bằng dd HCl vừa đủ, thu được 2,24 lít (đktc). Thành phần phần trăm theo khối lượng của FeO trong hỗn hợp là?
Câu 2: Cho m gam hỗn hợp Zn, Fe tác dụng với vừa đủ với 73 g dd HCl 10%. Cô cạn dd thu được 13,15 g muối. Giá trị m là?
Câu 3: Cho 15 gam hỗn hợp bột kim loại Zn và Cu vào dung dịch HCl dư, sau khi phản ứng xảy ra hoàn toàn thu được 4,48 lít khí H2 (đktc) và m gam chất rắn không tan. Giá trị của m là?
Câu 4: Kim loại tác dụng được với axit HCl loãng và khí clo cho cùng một loại muối clorua kim loại là?
Câu 5: Cho 10,5g hỗn hợp bột Mg, Fe tác dụng với dung dịch HCl dư thấy có 0,4g khí H2 bay ra. Khối lượng muối thu được sau phản ứng là?
3.2. Bài tập trắc nghiệm
Câu 1: Chất nào sau đây có tên gọi là hiđroclorua?
A. dd HCl.
B. khí Cl2.
C. khí HCl.
D. dd HClO.
Câu 2: Trộn dd chứa 1 g HCl vào dd chứa 1 g NaOH. Nhúng giấy quì tím vào dung dịch thu được thì giấy quì tím chuyển sang màu gì?
A. Màu đỏ.
B. Màu xanh.
C. Không màu.
D. Màu tím.
Câu 3: Trong muối NaCl có lẫn NaBr và NaI. Để loại hai muối này ra khỏi NaCl người ta có thể
A. nung nóng hỗn hợp.
B. cho hỗn hợp tác dụng với dung dịch HCl đặc.
C. cho hỗn hợp tác dụng với Cl2 sau đó đun nóng.
D. cả A, B và C.
Câu 4: Cho lượng dư dung dịch AgNO3 vào dung dịch hỗn hợp gồm 0,1 mol NaF và 0,1 mol NaCl. Khối lượng kết tủa tạo thành là
A. 14,35 g.
B. 10,8 g.
C. 21,6 g.
D. 27,05 g.
Câu 5: Cho 0,3 gam một kim loại hóa trị II phản ứng hết với dung dịch HCl dư, thu được 0,28 lít H2 (đktc). Kim loại đó là?
A. Ba
B. Ca.
C. Mg.
D. Sr.
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Hiđro clorua, axit clohiđric và muối clorua Hóa học 10 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Hiđro clorua là chất khí tan nhiều trong nước và có một số tính chất riêng, không giống với axit clohiđric (không làm đổi màu quỳ tím, không tác dụng với đá vôi).
- Tính chất chung của axit, axit clohiđric còn có tính chất riêng là tính khử do nguyên tố clo trong phân tử HCl có số oxi hoá thấp nhất là -1.
Tham khảo thêm
- doc Hoá học 10 Bài 21: Khái quát về nhóm halogen
- doc Hoá học 10 Bài 22: Clo
- doc Hoá học 10 Bài 24: Sơ lược về hợp chất có oxi của clo
- doc Hoá học 10 Bài 25: Flo - Brom - Iot
- doc Hoá học 10 Bài 26: Luyện tập Nhóm halogen
- doc Hoá học 10 Bài 27: Bài thực hành số 2 Tính chất hóa học của khí clo và hợp chất của Clo
- doc Hoá học 10 Bài 28: Bài thực hành số 3 Tính chất hóa học của Brom và Iot
