Hoá học 10 Bài 16: Luyện tập Liên kết hóa học
Nội dung bài giảng Luyện tập: Liên kết hóa học củng cố lại kiến thức về các loại liên kết hóa học chính để vận dụng, giải thích sự hình thành một số loại phân tử. Đặc điểm cấu trúc và đặc điểm liên kết của ba loại tinh thể. Rèn kĩ năng xác định hóa trị và số oxi hóa của nguyên tố trong đơn chất và hợp chất.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. So sánh liên kết ion và liên kết cộng hóa trị
- Liên kết ion:
+ Định nghĩa: Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
+ Bản chất của liên kết: Cho và nhận electron
+ Hiệu độ âm điện: ≥ 1,7
- Liên kết cộng hóa trị:
+ Định nghĩa: Liên kết cộng hoá trị là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
+ Bản chất của liên kết:
- Không cực: Đôi electron chung không lệch về nguyên tử nào.
- Có cực: Đôi e chung lệch về nguyên tử nào có độ âm điện lớn hơn.
+ Hiệu độ âm điện:
- Không cực : 0 → 0,4
- Có cực : 0,4 → < 1,7
1.2. So sánh tinh thể ion, tinh thể nguyên tử, tinh thể phân tử
- Tinh thể ion:
+ Khái niệm: Các cation và anion được phân bố luân phiên đều đặn ở các điểm nút của mạng tinh thể ion
+ Lực liên kết: Các ion mang điện tích trái dấu hút nhau bằng lực hút tĩnh điện, lực này lớn.
+ Đặc tính: Bền, khá rắn, khó bay hơi, khó nóng chảy
- Tinh thể nguyên tử:
+ Khái niệm: Ở các điểm nút mạng tinh thể nguyên tử là những nguyên tử
+ Lực liên kết: Các nguyên tử liên kết với nhau bằng lực liên kết cộng hóa trị, lực này rất lớn.
+ Đặc tính: Bền, khá cứng, khó nóng chảy, khó bay hơi
- Tinh thể phân tử:
+ Khái niệm: Ở các điểm nút của mạng tinh thể phân tử là các phân tử
+ Lực liên kết: Các phân tử liên kết với nhau bằng lực hút giữa các phân tử, yếu hơn nhiều lực hút tĩnh điện giữa các ion và lực liên kết cộng hóa trị
+ Đặc tính: Không bền, dễ nóng chảy, dễ bay hơi
2. Bài tập minh họa
2.1. Dạng 1: Bài tập sự hình thành liên kết ion
Bài 1. Viết cấu hình electron của Cl (Z = 17) và Ca (Z=20). Cho biết vị trí của chúng (chu kì, nhóm) trong bảng tuần hoàn. Liên kết giữa canxi và clo trong hợp chất CaCl2 thuộc loại liên kết gì? Vì sao? Viết sơ đồ hình thành liên kết đó.
Hướng dẫn giải
Cl (Z = 17) : 1s22s22p63s23p5
Ca (Z = 20) : 1s22s22p63s23p64s2
Clo nằm ở ô số 17, chu kỳ 3, nhóm VIIA.
Canxi nằm ở ô số 20, chu kỳ 4, nhóm IIA.
Liên kết trong hợp chất CaCl2 là liên kết ion vì Ca là kim loại điển hình, Cl là phi kim điển hình.
Sơ đồ hình thành liên kết:
2Cl + 21e → 2Cl-
Ca → Ca2+ + 2e
Các ion Ca2+và Cl-tạo thành mang điện tích trái dấu, chúng hút nhau bằng lực hút tĩnh điện, tạo thành hợp chất CaCl2:
Ca2+ + 2Cl- → CaCl2
Bài 2. Hai nguyên tố M và X tạo thành hợp chất có công thức là M2X. Cho biết:
- Tổng số proton trong hợp chất bằng 46.
- Trong hạt nhân của M có n - p = 1, trong hạt nhân của X có n’ = p’.
- Trong hợp chất M2X, nguyên tố X chiếm khối lượng.
a. Tìm số hạt proton trong nguyên tử M và X.
b. Dựa vào bảng tuần hoàn hãy cho biết tên các nguyên tố M, X.
c. Liên kết trong hợp chất M2X là liên kết gì? Tại sao? Viết sơ đồ hình thành liên kết trong hợp chất đó.
Hướng dẫn giải
a. Tổng số proton trong hợp chất M2X bằng 46 nên : 2p + p’ = 46. (1)
Trong hợp chất M2X, nguyên tố X chiếm khối lượng nên:
39p’ = 8(2p + 1). (2)
Từ (1), (2) ta tìm được: p = 19; p’ = 8.
b. M là kali (K) và X là oxi (O).
c. Liên kết trong hợp chất K2O là liên kết ion vì K là kim loại điển hình, O là phi kim điển hình.
Sơ đồ hình thành liên kết:
O + 2e → O2-
2K → 2K+ + 2.1e
Các ion K+và O2-tạo thành mang điện tích trái dấu, chúng hút nhau bằng lực hút tĩnh điện, tạo thành hợp chất K2O:
2K+ + O2- → K2O
2.2. Dạng 2: Sự hình thành liên kết cộng hóa trị
Bài 1. Dựa vào hiệu độ âm điện các nguyên tố, hãy cho biết có loại liên kết nàotrong các chất sau đây:
AlCl3, CaCl2, CaS, Al2S3?
Hướng dẫn giải
Hiệu dộ âm điện CaCl2 : 2, 16 → Liên kết ion.
Hiệu độ âm điện AlCl3, CaS, Al2S3lần lượt là : 1,55 ; 1,58 ; 0,97 → Liên kết cộng hóa trị có cực.
Bài 2. X, A, Z là những nguyên tố có số điện tích hạt nhân là 9, 19, 8.
a) Viết cấu hình electron nguyên tử của các nguyên tố đó.
b) Dự đoán liên kết hóa học có thể có giữa các cặp X và A, A và Z, Z và X.
Hướng dẫn giải
a) 9X : 1s22s22p5 Đây là F có độ âm điện là 3,98.
19A : 1s22s22p63s23p64s1Đây là K có độ âm điện là 0,82.
8Z: 1s22s22p4 Đây là O có độ âm điện là 3,44.
b) Cặp X và A, hiệu số độ âm điện là: 3,98 – 0,82 = 3,16 , có liên kết ion.
Cặp A và Z, hiệu số độ âm điện là: 3,44 – 0,82 = 2,62, có liên kết ion.
Cặp X và Z, hiệu số độ âm điện là: 3,98 – 3,44 = 0,54, có liên kết cộng hóa trị có cực
2.3. Dạng 3: Cách viết công thức cấu tạo của các phân tử
Bài 1. Trình bày sự hình thành liên kết cho nhận trong các phân tử và sau H3O+, HNO3
Hướng dẫn giải
- Xét H3O+ ta có
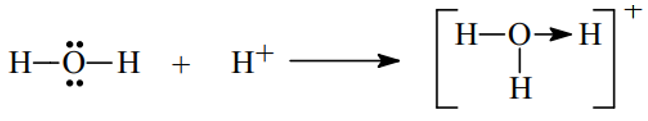
- Xét phân tử HNO3
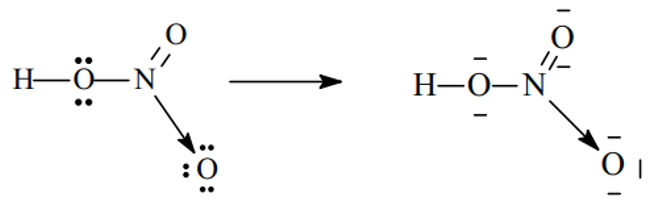
Sau khi hình thành các liên kết cộng hóa trị, N (chứ không phải O) sẽ cho 1 cặp electron đến nguyên tử O thứ ba (đang thiếu 2e để đạt cấu hình khí trơ) hình thành liên kết cho - nhận.
2.4. Dạng 4: Bài tập về hóa trị và số oxi hóa
Bài 1. Số oxi hóa của nitơ trong NH4+, NO2- , và HNO3 lần lượt là:
A. +5, -3, +3.
B. -3, +3, +5
C. +3, -3, +5
D. +3, +5, -3.
Hướng dẫn giải
Đặt x, y, z lần lượt là số oxi hóa của nguyên tố nitơ trong NH4+, NO2- , và HNO3
Ta có: x + 4.1 = 1 ⇒ x = -3. Số OXH của N trong NH4+là -3
y + 2.(-2) = -1 ⇒ y = 3. Số OXH của N trong NO2- là +3
z + 1 + 3.(-2) = 0 ⇒ z = 5. Số OXH của N trong HNO3 là +5
⇒ Chọn B.
Bài 2. Xác định số oxi hóa của các nguyên tố trong hợp chất , đơn chất và ion sau:
a) H2S, S, H2SO3, H2SO4.
b) HCl, HClO, NaClO2, HClO3.
c) Mn, MnCl2, MnO2, KMnO4.
Hướng dẫn giải
a) Số oxi hóa của S trong các chất lần lượt là: S-2, S0, S+4, S+6
b) Số oxi hóa của Cl trong các hợp chất: Cl-1, Cl+1,Cl+3, Cl+5, Cl+7.
c) Số oxi hóa của Mn trong các chất: Mn0, Mn+2, Mn+4, Mn+7
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Một hợp chất có công thức XY2 trong đó Y chiếm 50% về khối lượng. Trong hạt nhân của X có n = p và hạt nhân Y có n’ = p’. Tổng số proton trong phân tử XY2 là 32. Cấu hình electron của X và Y và liên kết trong phân tử XY2 là?
Câu 2: Hợp chất tạo bởi các nguyên tử có cấu hình electron ở trạng thái cơ bản là 1s22s1 và 1s22s22p5 có liên kết thuộc loại?
Câu 3: Phân tử XY3 có tổng số các hạt proton, electron, nowtron bằng 196. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 60, số hạt mang điện của X ít hơn số hạt mang điện của Y trong phân tử là 76. Công thức hóa học của XY3 là?
Câu 4: Xác định số oxi hóa của nguyên tố trung tâm trong các hợp chất sau: HNO3, H2S, NaNO3, K2SO4, KMnO4, K2Cr2O7?
3.2. Bài tập trắc nghiệm
Câu 1: Cho các nguyên tử X, Y:
Tổng số các loại hạt cơ bản trong nguyên tử X là 34. Số hạt mang điện nhiều hơn số hạt không mang điện là 10.
Kí hiệu của nguyên tử Y là 919Y.
Công thức hóa học và liên kết trong hợp chất tạo thành từ X và Y là
A. XY và liên kết cộng hóa trị
B. X2Y và liên kết ion
C. XY và liên kết ion
D. XY2 và liên kết cộng hóa trị
Câu 2: Liên kết hóa học giữa các nguyên tử trong phân tử H2O là liên kết
A. cộng hóa trị không phân cực
B. hidro
C. ion
D. cộng hóa trị phân cực
Câu 3: Cho các chất: HBr, HI, HCl. Mức độ phân cực của liên kết hóa học trong phân tử các chất này được sắp xếp theo thứ tự giảm dần từ trái sang phải là
A. HBr, HI, HCl
B. HI, HBr, HCl
C. HCl, HBr, HI
D. HI, HCl, HBr
Câu 4: Các chất mà phân tử không phân cực là
A. H2O, CO2, CH4
B. O2, CO2, C2H2
C. NH3, Cl2, C2H4
D. HBr, C2H6, I2
Câu 5: Cấu hình electron lớp ngoài cùng của nguyên tử Cl (Z=17), Ca (Z=20) và liên kết giữa canxi và clo trong hợp chất CaCl2 lần lượt là
A. 3s23p5, 4s1 và liên kết cộng hóa trị
B. 3s23p3, 4s2 và liên kết ion
C. 3s23p5, 4s2 và liên kết ion
D. 3s23p3, 4s1 và liên kết cộng hóa trị
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Luyện tập Liên kết hóa học Hóa học 10 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Kiến thức về các loại liên kết hóa học chính để vận dụng, giải thích sự hình thành một số loại phân tử.
- Đặc điểm cấu trúc và đặc điểm liên kết của ba loại tinh thể.
- Xác định hóa trị và số oxi hóa của nguyên tố trong đơn chất và hợp chất.
