Hoá học 10 Bài 24: Sơ lược về hợp chất có oxi của clo
Nội dung bài giảng Sơ lược về hợp chất có oxi của clo tìm hiểu nước Javen và Clorua vôi có thành phần, tính chất, cấu tạo như thế nào? Chúng được dùng làm gì và được điều chế bằng cách nào?
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Thành phần, tính chất và ứng dụng của nước Javel và clorua vôi
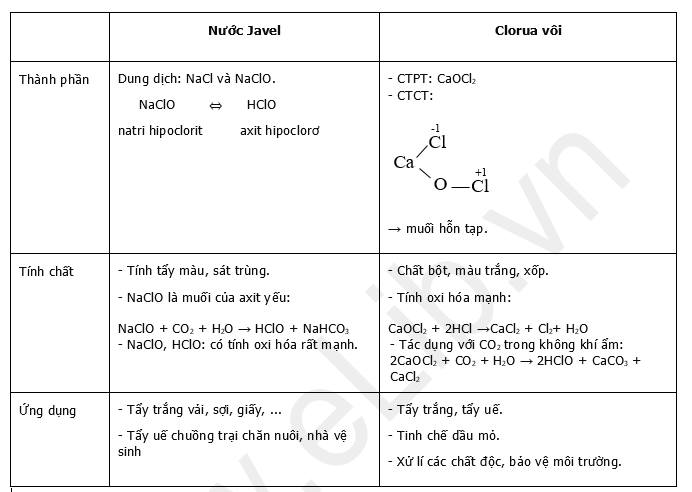
a. Nước Javel
- Nước Javel là dung dịch hỗn hợp muối NaCl và NaClO.
- Muối NaClO có tính oxi hóa rất mạnh, do vậy nước Javel có tính tẩy màu, sát trùng, tẩy trắng vải, sợi, giấy và dùng sát trùng chuồng trại chăn nuôi, nhà vệ sinh.
- NaClO là muối của axit rất yếu, yếu hơn axit cacbonic nên dễ tác dụng với CO2 của không khí tạo thành axit HClO có tính oxi hóa mạnh.
⇒ nước Javel không để được lâu trong không khí.
b. Clorua vôi CaOCl2
- Clorua vôi là chất bột màu trắng, xốp, mùi xốc, có tính oxi hóa mạnh.
- Tác dụng với axit clohidric cho Cl2
CaOCl2 + 2HCl → CaCl2 + Cl2 + H2O
- Trong không khí ẩm, clorua vôi tác dụng với CO2 tạo ra axit hipoclorơ
1.2. Điều chế nước Javel và clorua vôi
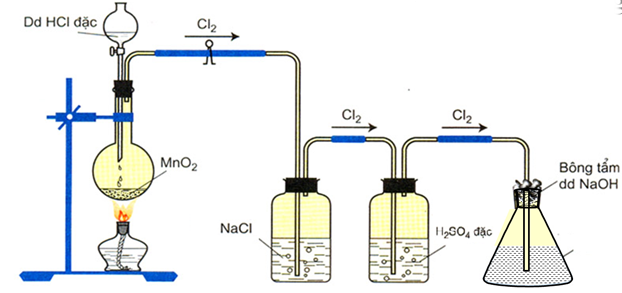
a. Điều chế nước Javel
- Trong phòng thí nghiệm:
Cho khí clo tác dụng với NaOH loãng ở nhiệt độ thường:
Cl2 + 2NaOH → NaCl + NaClO + H2O
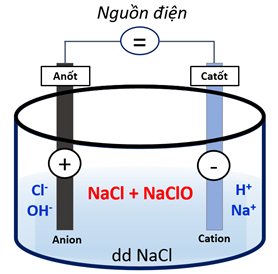
- Trong công nghiệp:
Điện phân dung dịch NaCl nồng độ 15 – 20% trong thùng điện phân không có màng ngăn.
2NaCl + 2H2O → 2NaOH + H2 + Cl2
Cl2 + 2NaOH → NaCl + NaClO + H2O
b. Điều chế clorua vôi
Cho clo tác dụng với vôi tôi (sữa vôi) ở 30oC thu được clorua vôi:
Cl2 + Ca(OH)2 → CaOCl2 + H2O (to = 30OC)

2. Bài tập minh họa
2.1. Dạng 1: Phương trình chuyển hóa
Bài 1: Viết phương trình phản ứng biểu diễn sơ đồ chuyển hóa sau:
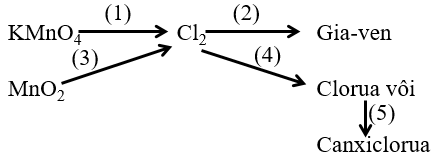
Hướng dẫn giải
(1) 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
(2) Cl2 + 2NaOH → NaCl + NaClO + H2O
(3) MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
(4) Cl2 + Ca(OH)2 → CaOCl2 + H2O ĐK: Ở 30oC
(5) CaOCl2 + 2HCl → CaCl2 + Cl2 + H2O
Hoặc CaOCl2 →CaCl2 + 1/2O2 ĐK: toc
Bài 2: Viết các phương trình phản ứng điều chế nước Javel từ các chất có trong phòng thí nghiệm: NaCl, MnO2, H2SO4 đặc, NaOH
Hướng dẫn giải
Điều chế axit HCl từ NaCl, H2SO4 đặc, H2O
NaCl (r) + H2SO4 (đặc) → NaHSO4 + HCl ĐK: tOC
Từ HCl và MnO2 điều chế khí Cl2
MnO2 + 4HCl (đặc) → MnCl2 + Cl2 + 2H2O ĐK: tOC
Từ Cl2 và dung dịch NaOH loãng nguội điều chế nước Javel
Cl2+ 2NaOH → NaCl + NaClO + H2O
2.2. Dạng 2: Bài toán nhận biết
Bài 1: Chỉ dùng một thuốc thử, hãy nhận biết các dung dịch mất nhãn sau: HCl, HClO, NaCl, NaClO
Hướng dẫn giải
Sử dụng quỳ tím:
HCl → Qùy tím hóa đỏ
HClO → Qùy tím không đổi màu
NaCl → Qùy tím mất màu
NaClO → Qùy tím hóa đỏ rồi mất màu
Bài 2: Hòa tan khí Cl2 vào dung dịch NaOH loãng, dư ở nhiệt độ phòng thu được dung dịch chứa các chất
A. NaCl, NaClO3, Cl2
B. NaCl, NaClO, NaOH
C. NaCl, NaClO3, NaOH
D. NaCl, NaClO3
Hướng dẫn giải
Cl2 + 2NaOH → NaCl + NaClO + H2O
Dung dịch còn chứa NaOH dư.
Đáp án B
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Dung dịch nước clo có màu gì?
Câu 2: Dung dịch hỗn hợp hai muối Natri clorua và Natrihipoclorit được gọi là gì?
Câu 3: Hấp thụ hoàn toàn 2,24 lít khí Cl2 (đktc) vào 200 ml dung dịch NaOH (ở nhiệt độ thường). Sau phản ứng, nồng độ NaOH còn lại là 0,5M (giả thiết thể tích dung dịch không thay đổi). Nồng độ mol ban đầu của dung dịch NaOH là?
Câu 4: Hiện tượng quan sát được khi thêm dần nước clo vào dung dịch KI có chứa sẵn một ít hồ tinh bột là gì?
Câu 5: Cho 56 lít khí clo (ở đktc) đi qua một lượng dư sữa vôi, ở 30 độ C. Khối lượng clorua vôi tạo thành là?
3.2. Bài tập trắc nghiệm
Câu 1: Thành phần các chất có trong nước clo là
A. HCl, HClO
B. HCl, HClO, Cl2, H2O
C. HCl, Cl2
D. Cl2
Câu 2: Trong phòng thí nghiệm nước Gia-ven được điều chế bằng cách nào sau đây?
A. Cho khí clo tác dụng với nước.
B. Cho khí clo tác dụng với dung dịch Ca(OH)2.
C. Cho khí clo sục vào dung dịch NaOH loãng.
D. Cho khí clo vào dung dịch KOH loãng rồi đun nóng 100oC.
Câu 3: Trong công nghiệp nước Gia-ven được sản xuất bằng cách nào sau đây?
A. Sục khí clo vào nước.
B. Sục khí clo vào nước vôi trong.
C. Điện phân dung dịch NaCl, không có màng ngăn.
D. Điện phân nóng chảy NaCl.
Câu 4: Người ta sử dụng clo để sát trùng nước máy. Nhận xét đúng là
A. Clo độc nên có tính diệt khuẩn.
B. Clo có tính oxi hóa mạnh nên có khả năng diệt khuẩn.
C. Clo tác dụng với nước tạo thành HClO là chất oxi hóa mạnh nên có khả năng diệt khuẩn.
D. Clo tác dụng với nước tạo ra HCl là axit mạnh nên có khả năng diệt khuẩn.
Câu 5: Cho mẩu quỳ tím vào cốc chứa 100 ml nước. Sau đó dẫn từ từ khí Cl2 vào trong cốc. Hiện tượng thu được là
A. Mẩu quỳ tím mất màu.
B. Mẩu quỳ tím không đổi màu.
C. Mẩu quỳ tím chuyển sang màu xanh.
D. Mẩu quỳ tím chuyển sang màu đỏ, sau đó mất màu.
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Sơ lược về hợp chất có oxi của clo Hóa học 10 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học các em nắm đươc:
- Tính chất, ứng dụng và thành phần của nước Javel và Clorua vôi
- So sánh tính chất hóa học cơ bản của chúng
- Nắm được một số phương pháp điều chế nước Javel và Clorua vôi
Tham khảo thêm
- doc Hoá học 10 Bài 21: Khái quát về nhóm halogen
- doc Hoá học 10 Bài 22: Clo
- doc Hoá học 10 Bài 23: Hiđro clorua - Axit clohiđric và muối clorua
- doc Hoá học 10 Bài 25: Flo - Brom - Iot
- doc Hoá học 10 Bài 26: Luyện tập Nhóm halogen
- doc Hoá học 10 Bài 27: Bài thực hành số 2 Tính chất hóa học của khí clo và hợp chất của Clo
- doc Hoá học 10 Bài 28: Bài thực hành số 3 Tính chất hóa học của Brom và Iot
