Hoá học 10 Bài 2: Hạt nhân nguyên tử - Nguyên tố hóa học - Đồng vị
Nội dung bài giảng giải thích sự liên quan giữa số đơn vị điện tích hạt nhân với số proton và số electron; Đề cập đến cách tính số khối của hạt nhân; các khái niệm thế nào là nguyên tố hóa học, đồng vị, nguyên tử khối, nguyên tử khối trung bình...
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Hạt nhân nguyên tử
a. Điện tích hạt nhân
- Nếu hạt nhân nguyên tử có Z hạt proton thì điện tích hạt nhân là Z+ và số đơn vị điện tích hạt nhân là Z.
- Số đơn vị điện tích hạt nhân = số p = số e = Z
b. Số khối
Số khối của hạt nhân (A) bằng tổng số prton (Z) và tổng số nơtron (N)
Công thức: A = Z + N
1.2. Nguyên tố hóa học
a. Định nghĩa
- Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân nhưng khác số khối.
- Những nguyên tử có cùng điện tích hạt nhân đều có tính chất hóa học giống nhau.
b. Số hiệu nguyên tử
- Số đơn vị điện tích hạt nhân (Z) của một nguyên tố được gọi là số hiệu nguyên tử của nguyên tố đó.
- Vậy: số hiệu nguyên tử = số đơn vị điện tích hạt nhân = số p = số e = Z
c. Kí hiệu nguyên tử
\({}_Z^AX\)
- X là kí hiệu nguyên tố.
- A là số khối (A = Z + N)
- Z là số hiệu nguyên tử
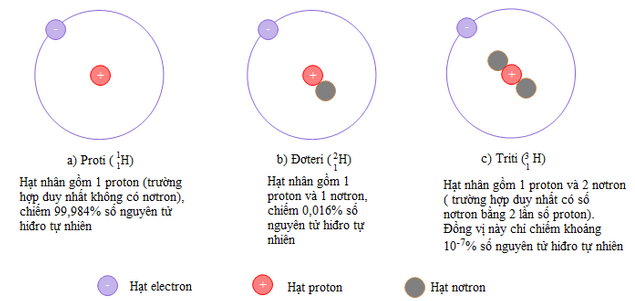
1.3. Đồng vị
- Đồng vị là những nguyên tử có cùng số proton nhưng khác số nơtron, do đó số khối của chúng khác nhau.
- Ví dụ:
+ Hiđro có 3 đồng vị là: \({}_1^1H;_1^2H;_1^3H\)
+ Clo có 2 đồng vị là: \(_{17}^{35}Cl;_{17}^{37}Cl\)
1.4. Nguyên tử khối và nguyên tử khối trung bình
a. Nguyên tử khối
+ Nguyên tử khối là khối lượng tương đối của nguyên tử.
+ Công thức: A = mP + mn
+ Nguyên tử khối cho biết khối lượng nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử.
b. Nguyên tử khối trung bình
- Công thức: \(\bar A = \frac{{{A_1}.x + {A_2}.y + {A_3}.z + ....{A_n}.n}}{{100}}\)
+ Trong đó A1, A2, A3,….là số khối của các đồng vị.
+ x, y, z,….là thành phần trăm của các đồng vị.
Ví dụ 1: Clo có hai đồng vị là \(_{17}^{35}Cl;_{17}^{37}Cl\)
Nguyên tử khối trung bình của Cl là:
\(\bar A = \frac{{{A_1}.x + {A_2}.y}}{{100}} = \frac{{35.75,77 + 37.24,23}}{{100}} = 35,5\)
Ví dụ 2: Xét 50 nguyên tử X thì có 27 nguyên tử X1 và 23 nguyên tử X2.
Số khối A1 = 35 + 44 =79; A2 =35 + 46=81
Ta có: \(\bar A = \frac{{79.27 + 81.23}}{{50}} = 79,92\)
2. Bài tập minh họa
2.1. Dạng 1: Tìm số P, E, N, số khối A – Viết kí hiệu nguyên tử
Bài 1: Nguyên tử Nhôm có điện tích hạt nhân là 13+. Trong nguyên tử Al số hạt mang điện nhiều hơn số hạt không mang điện là 12 hạt. Số khối của Al là:
A. 13
B. 14
C. 27
D. 26
Hướng dẫn giải
Điện tích hạt nhân là 13+ ⇒ p = 13
Số hạt mang điện là p và e; số hạt không mang điện là n
⇒ p + e – n = 12
Mà p = e ⇒ 2p – e = 12
Thay p = 13 ⇒ n = 26 – 12 = 14
⇒ A = p + n = 13 + 14 = 27
⇒ Đáp án C
Bài 2: Biết nguyên tử B có tổng số hạt là 21. Số hạt không mang điện chiếm 33,33%. Kí hiệu nguyên tử B là:
A. \({}_7^{14}B\)
B. \({}_7^7X\)
C. \({}_{14}^7X\)
D. \({}_7^{21}X\)
Hướng dẫn giải
Số hạt không mang điện chiếm 33,33% ⇒ % n = 33,33;
Tổng số hạt = 21
⇒ n = 33,33%.21 = 7 (1)
Ta có: p + n + e = 21 mà p = e ⇒ 2p + n = 21 (2)
Thay n = 21 ⇒ p = e = (21−7) : 2 = 7
A = p + n = 7 + 7 = 14; Z = p = e = 7
⇒ Kí hiệu nguyên tử B: \({}_7^{14}B\)
⇒ Đáp án A
Bài 3: Tổng số hạt trong nguyên tử X là 28. Số hạt p, n, e của X lần lượt là:
A. 8; 12; 8
B. 9; 10; 9
C. Không xác định được
D. Cả A và B
Hướng dẫn giải
Tổng số hạt = 28 ⇒ p + n + e = 28 ⇒ 2p + n = 28
Ta có: p < n < 1,5p
⇒ 3p ≤ 2p + n = 28 ≤ 3,5p
⇒ 8 ≤ p ≤ 9,3 mà p ∈ N
⇒ \(\left\{ \begin{array}{l}
p = 8 \to n = 12\\
p = 9 \to n = 10
\end{array} \right.\)
⇒ Đáp án D
Bài 4: Oxit X có công thức R2O. Tổng số hạt cơ bản (p, n, e) trong X là 92, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 28. X là chất nào dưới đây (biết rằng trong hạt nhân nguyên tử oxi có 8 proton và 8 nơtron)?
A. N2O
B. Na2O
C. Cl2O
D. K2O
Hướng dẫn giải
Tổng số hạt cơ bản (p, n, e) trong X là 92
⇒ 2. (2pR + nR) + 2pO + nO = 92
Ta có: pO = 8 ; nO = 8
⇒ 2. (2pR + nR) = 68 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 28
⇒ (2.2pR + 2.nO ) - (2nR + nO) = 28
⇒ 4pR - 2nR = 20 (2)
Từ (1), (2) ⇒ pR = 11, nR = 12 ⇒ R là Na
⇒ Đáp án B
2.2. Dạng 2: Xác định nguyên tử khối trung bình, số khối, % các đồng vị
Bài 1: Gali (với khối lượng nguyên tử 69,72) trong tự nhiên là hỗn hợp hai đồng vị, trong đó đồng vị 69Ga có khối lượng nguyên tử 68,9257 chiếm 60,47%. Khối lượng nguyên tử của đồng vị còn lại là
A. 69,9913
B. 70,2163
C. 70,9351
D. 71,2158
Hướng dẫn giải
Gọi khối lượng nguyên tử của đồng vị còn lại là M
Ta có:
\({M_{Ga}} = 69,72 = \frac{{60,47.68,9257 + M.(100 - 60,47)}}{{100}}\)
⇒ M = 70,9351
⇒ Đáp án C
Bài 2: Nguyên tố X có 3 đồng vị: A1 chiếm 92,3%, A2 chiếm 4,7% và A3 chiếm 3%. Tổng số khối của 3 đồng vị là 87. Số nơtron trong 1 nguyên tử A2 nhiều hơn trong nguyên tử A1 là một hạt. Nguyên tử khối trung bình của X là 28,107. Vậy số khối của 3 đồng vị là:
A. 27,28,32
B. 26,27, 34
C. 28,29,30
D. 29,30,28
Hướng dẫn giải
Gọi số khối của X lần lượt là A1, A2, A3
A1; A2; A3 là đồng vị nên có số p bằng nhau
Số nơtron trong 1 nguyên tử A2 nhiều hơn trong nguyên tử A1 là một hạt
⇒ A2 – A1 = 1
Ta có hệ:
\(\left\{ \begin{array}{l}
{A_1} + {A_2} + {A_3} = 87\\
{A_2} - {A_1} = 1\\
\frac{{92,3.{A_1} + 4,7.{A_2} + 3.{A_3}}}{{100}} = 28,107
\end{array} \right.\)
→ \(\left\{ \begin{array}{l}
{A_1} = 28\\
{A_2} = 29\\
{A_3} = 30
\end{array} \right.\)
⇒ Đáp án C
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Biết rằng nguyên tố agon có ba đồng vị khác nhau, ứng với số khối 36; 38 và A. Phần trăm các đồng vị tương ứng lần lượt bằng: 0,34%; 0,06% và 99,6%. Số khối của đồng vị A của nguyên tố agon là? biết rằng nguyên tử khối trung bình của agon bằng 39,98.
Câu 2: Mỗi phân tử XY2 có tổng các hạt proton, nơtron, electron bằng 178; trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 54, số hạt mang điện của X ít hơn số hạt mang điện của Y là 12. Hãy xác định kí hiệu hoá học của X, Y lần lượt là?
Câu 3: Trong tự nhiên hidro chủ yếu tồn tại 2 đồng vị 11H và 12H (còn gọi là đơteri, kí hiệu là D). Nước tự nhiên tồn tại dạng nước bán nặng (HOD) và nước thường (H2O). Để tách được 1 gam nước bán nặng cần lấy bao nhiêu gam nước tự nhiên? Cho biết nguyên tử khối của oxi là 16, nguyên tử khối của hidro là 1,008?
Câu 4: Trong tự nhiên, X có hai đồng vị 1735X và 1737X, chiếm lần lượt 75,77% và 24,23% số nguyên tử X. Y có hai đông vị à 11Y và 12Y, chiếm lần lượt 99,2% và 0,8% số nguyên tử Y.
a) Trong tự nhiên có bao nhiêu loại phân tử XY?
b) Phân tử khối trung bình của XY là
Câu 5: Khi dung hạt 2048Ca bắn vào hạt nhân 95243Am thì thu được một hạt nhân siêu nặng, đồng thời có 3 nơtron bị tách ra. Cấu tạo hạt nhân nguyên tố siêu nặng này gồm?
3.2. Bài tập trắc nghiệm
Câu 1: Hai nguyên tử C và B có cùng
A. số proton.
B. số nơtron.
C. tính chất vật lý.
D. tính chất hóa học.
Câu 2: Có những phát biểu sau đây về các đồng vị của cùng một nguyên tố hóa học:
Các đồng vị có tính chất hóa học giống nhau.
Các đồng vị có tính chất vật lí khác nhau.
Các đồng vị có cùng số electron ở vỏ nguyên tử.
Các đồng vị có cùng số proton nhưng khác nhau về số khối.
Trong các phát biểu trên, số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 3: Nguyên tử của nguyên tố A có 56 electron, trong hạt nhân có 81 nơtron. Kí hiệu của nguyên tử nguyên tố A là
A. 56137A
B. 13756A
C. 5681A
D. 8156A
Câu 4: Trong tự nhiên, oxi có 3 đồng vị là 16O, 17O, 18O. Có bao nhiêu loại phân tử O2?
A. 3.
B. 6.
C. 9.
D. 12.
Câu 5: Cho các phát biểu sau:
(1). Tất cả các hạt nhân nguyên tử đều được cấu tạo từ các hạt proton và notron.
(2). Khối lượng nguyên tử tập trung phần lớn ở lớp vỏ.
(3). Trong nguyên tử số electron bằng số proton.
(4). Trong hạt nhân nguyên tử hạt mang điện là proton và electron.
(5). Trong nguyên tử, hạt electron có khối lượng không đáng kể so với các hạt còn lại.
Số phát biểu đúng là
A. 1
B. 2
C. 3
D. 4
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Hạt nhân nguyên tử - Nguyên tố hóa học - Đồng vị Hóa học 10 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Sự liên quan giữa số đơn vị điện tích hạt nhân với số proton và số electron.
- Đề cập đến cách tính số khối của hạt nhân.
- Các khái niệm thế nào là nguyên tố hóa học, đồng vị, nguyên tử khối, nguyên tử khối trung bình...
