Hoá học 10 Bài 35: Bài thực hành số 5 Tính chất các hợp chất của lưu huỳnh
Nội dung Bài thực hành số 5 Tính chất các hợp chất của lưu huỳnh trình bày mục đích, các bước tiến hành, kĩ thuật thực hiện các thí nghiệm: Tính khử của Hiđro sunfua; Tính khử và tính oxi hóa của Lưu huỳnh đioxit; Tính oxi hóa mạnh của axit sunfuric đặc.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Mục đích thí nghiệm
- Nghiên cứu các tính chất cơ bản của Lưu huỳnh và hợp chất của lưu huỳnh
- Nắm được các bước tiến hành, kĩ thuật thực hiện các thí nghiệm
1.2. Kỹ năng thí nghiệm
Chỉ được làm thí nghiệm khi có sự hiện diện của giáo viên trong phòng thí nghiệm.
- Đọc kỹ hướng dẫn và suy nghĩ trước khi làm thí nghiệm.
- Luôn luôn nhận biết nơi để các trang thiết bị an toàn.
- Phải mặc áo choàng của phòng thí nghiệm.
- Phải mang kính bảo hộ.
- Phải cột tóc gọn lại.
- Làm sạch bàn thí nghiệm trước khi bắt đầu một thí nghiệm.
- Không bao giờ được nếm các hóa chất thí nghiệm. Không ăn hoặc uống trong phòng thí nghiệm.
- Không được nhìn xuống ống thí nghiệm.
- Nếu làm đổ hóa chất hoặc xảy ra tại nạn, báo cho giáo viên ngay lập tức.
- Rửa sạch da khi tiếp xúc với hóa chất.
- Nếu hóa chất rơi vào mắt, phải đi rửa mắt ngay lập tức.
- Bỏ chất thải thí nghiệm vào đúng nơi qui định như được hướng dẫn.
1.3. Cơ sở lý thuyết
a. Điều chế và thử tính chất của Hiđro Sunfua
FeS + 2HCl → FeCl2 + H2S
2H2S + 3O2 → 2SO2 + 2H2O
b. Tính khử của Lưu huỳnh Đioxit
SO2 + 2H2O + Br2 → H2SO4+ 2HBr
c. Tính oxi hóa của Lưu huỳnh Đioxit
SO2 + 2H2S → 3S + 2H2O
d. Tính oxi hóa của Axit Sunfuric đặc
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
1.4. Dụng cụ thí nghiệm, hóa chất
a. Dụng cụ thí nghiệm
- Ống nghiệm, nút cao su, ống vuốt nhọn ngắn, giá đỡ, que đóm, đèn cồn
- Kẹp gỗ, ống dẫn khí
- Dụng cụ điều chế H2S
- Bông, đèn cồn...
b. Hóa chất
- Dung dịch HCl, FeS.
- Dung dịch H2SO4, Na2SO3, dung dịch Br2.
- Dung dịch H2S, khí SO2.
- Dung dịch H2SO4 đặc, lá đồng nhỏ, kiềm (hoặc dung dịch KMnO4)
1.5. Cách tiến hành thí nghiệm
a. Điều chế và thử tính chất của Hiđro Sunfua
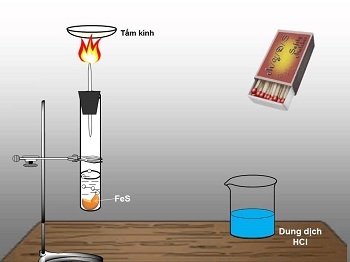
+ Dùng một ống nghiệm có chứa FeS lên giá đỡ, dùng ống nhỏ giọt chứa sẵn dd HCl gắn vào nút cao su có dây dẫn khí, đậy kín ống nghiệm.
+ Nhỏ dd HCl vào ống nghiệm, quan sát hiện tượng.
b. Tính khử của Lưu huỳnh Đioxit
+ Nối nhánh của ống nghiệm có nhánh với ống dẫn thủy tinh thẳng bằng ống dẫn cao su dài 3-5cm. Nhúng đầu ống dẫn thủy tinh vào ống dẫn khác chứa dung dịch Brom lõang(có thể dùng dung dịch KMnO4 loãng), Để ống nghiệm lên giá đỡ ống nghiệm, hoặc kẹp trên giá thí nghiệm.
+ Cho vào ống nghiệm có nhánh lượng nhỏ Na2SO3 (khoảng ½ thìa hóa chất nhỏ). Đậy ống nghiệm bằng nút cao su có kèm ống nhỏ giọtchứa H2SO4 đặc.
+ Bóp quả bóp cao su cho H2SO4 đặc chảy xuống tiếp xúc và tác dụng với Na2SO3.
+ Cần lưu ý lắp dụng cụ kín để khí SO2 không thoát ra ngoài vì khí SO2 không màu, mùi hắc, rất độc.
c. Tính oxi hóa của Lưu huỳnh Đioxit
+ Nối nhánh của ống nghiệm có nhánh với ống dẫn thủy tinh dài, một đầu nhúng vào ống nghiệm B chứa 2-3ml nước cất. Để ống nghiệm lên giá để ống nghiệm. Cho vào ống nghiệm A có nhánh 2-3 mẫu FeS bằng hạt ngô.
+ Đậy ống nghiệm bằng nút cao su có kèm ống nhỏ giọt chứa dung dịch HCl lõang. Bóp quả bóp cao su để dung dịch HCl chảy xuống, tiếp xúc với FeS. Khí H2S tạo thành được dẫn qua ống nghiệm B hòa tan trong nước thành dung dịch Axit Sunfuhiđric.
+ Dẫn khí SO2 được điều chế ở thí nghiệm 2 vào ống nghiệm B. Quan sát hiện tượng.
d. Tính oxi hóa của Axit Sunfuric đặc
+ Cho vào ống nghiệm (a) 1ml H2SO4 đặc, 1-2 mảnh phoi bào đống, kẹp ống nghiệm bằng kẹp gỗ, cắm kẹp gỗ vào để giá thí nghiệm.
+ Đậy ống nghiệm bằng nút cao su có kèm ống dẫn thủy tinh hình chữ L nối với ống nghiệm (b) chứa 2ml nước cất và mẩu giấy quỳ tím.
+ Dùng đèn cồn đun nóng nhẹ ống nghiệm (a).
+ Muốn thấy rõ màu xanh của dung dịch sau phản ứng ta nhỏ thêm vào vài giọt nước
2. Báo cáo thí nghiệm
2.1. Thí nghiệm 1: Điều chế và thử tính chất của Hiđro Sunfua
Hiện tượng:
H2S thoát ra có mùi trứng thối.
H2S cháy trong không khí ngọn lửa màu xanh.
Giải thích: Do xảy ra phản ứng
FeS + 2HCl → FeCl2 + H2S
2H2S + 3O2 → 2SO2 + 2H2O
→ H2S đóng vài trò là chất khử, O2 đóng vai trò là chất oxi hóa.
2.2. Thí nghiệm 2: Tính khử của Lưu huỳnh Đioxit
Hiện tượng: dung dịch Br2 từ từ mất màu nâu đỏ nhạt dần.
Giải thích:
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2↑
SO2 + Br2 + 2H2O→ 2HBr+ H2SO4
→ SO2 đóng vai trò là chất khử, Br2 đóng vai trò là chất oxi hóa.
2.3. Thí nghiệm 3: Tính oxi hóa của Lưu huỳnh Đioxit
Hiện tượng: Dung dịch trong ống nghiệm H2S vẩn đục màu vàng.
Giải thích: SO2 + 2H2S → 3S (màu vàng) + 2H2O
→ Trong phản ứng trên, SO2 đóng vai trò là chất oxi hóa, H2S đóng vai trò là chất khử.
2.4. Thí nghiệm 4: Tính oxi hóa của Axit Sunfuric đặc
- Hiện tượng
+ Lá đồng nhỏ bị tan.
+ Khí mùi hắc thoát ra.
+ Dung dịch có màu xanh.
+ Giấy quỳ chuyển dần sang màu đỏ.
- Giải thích: Dung dịch có bọt khí và từ không màu chuyển sang màu xanh.
Cu + 2H2SO4(đ) → CuSO4 + SO2 + 2 H2O
→ Đồng là chất khử H2SO4 đặc là chất oxi hóa
3. Luyện tập
Câu 1: Cho vào ống nghiệm 1 đến 2 ml dung dịch hidro sunfua, nhỏ tiếp từng giọt dung dịch SO2 vào ống nghiệm. Hiện tượng quan sát được là
A. Có bọt khí thoát ra, dung dịch thu được trong suốt.
B. Xuất hiện kết tủa màu trắng đục sau đó chuyển thành màu vàng nhạt.
C. Xuất hiện kết tủa màu trắng đục, sau đó kết tủa tan, dung dịch trong suốt.
D. Xuất hiện kết tủa màu nâu đỏ, sau đó kết tủa tan, dung dịch trong suốt.
Câu 2: Cách pha loãng axit H2SO4 đặc nào sau đây an toàn nhất?
A. Rót nhanh axit vào nước.
B. Rót nhanh nước vào axit.
C. Rót từ từ axit vào nước.
D. Rót từ từ nước vào axit.
Câu 3: Rót vào cốc chứa đường saccarozơ khoảng 10 đến 15 ml dung dịch H2SO4 đặc. Hiện tượng quan sát được là
A. đường tan trong axit tạo thành dung dịch trong suốt.
B. đường bị hóa than màu nâu đỏ, trên bề mặt than có sủi bọt khí.
C. đường tan trong axit tạo dung dịch có màu xanh.
D. đường bị hóa than màu đen, trên bề mặt than có sủi bọt khí.
Câu 4: Cho vào ống nghiệm vài mảnh đồng nhỏ, cho tiếp dung dịch axit sunfuric đặc vào ống nghiệm. Đun nóng ống nghiệm trên ngon lửa đền cồn. Hiện tượng quan sát được là
A. đồng tan cho dung dịch không màu, có bọt khí thoát ra không màu.
B. đồng tan cho dung dịch không màu, có bọt khí thoát ra màu nâu đỏ.
C. đồng tan cho dung dịch màu xanh, có bọt khí thoát ra không màu.
D. đồng tan cho dung dịch không màu, có bọt khí thoát ra màu nâu đỏ.
4. Kết luận
Nội dung bài thực hành sẽ giúp các em tìm hiểu và tiến hành một số thí nghiệm như điều chế và thử tính chất của Hiđo Sunfua, tính khử của lưu huỳnh đioxit, tính oxi hóa của lưu huỳnh Đioxit và thực hành oxi hóa của Axit Sunfuric đặc.
Tham khảo thêm
- doc Hoá học 10 Bài 29: Oxi - Ozon
- doc Hoá học 10 Bài 30: Lưu huỳnh
- doc Hoá học 10 Bài 31: Bài thực hành số 4 Tính chất của oxi, lưu huỳnh
- doc Hoá học 10 Bài 32: Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit
- doc Hoá học 10 Bài 33: Axit sunfuric - Muối sunfat
- doc Hoá học 10 Bài 34: Luyện tập Oxi và lưu huỳnh
