Hoá học 10 Bài 22: Clo
Nội dung bài giảng Clo tìm hiểu về Tính chất vật lí, trạng thái tự nhiên, ứng dụng của clo, phương pháp điều chế clo trong phòng thí nghiệm, trong công nghiệp. Kiến thức trọng tâm: Tính chất hoá học cơ bản của clo là phi kim mạnh, có tính oxi hoá mạnh (tác dụng với kim loại, hiđro), Clo còn thể hiện tính khử.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Sơ lược nguyên tố Clo
Kí hiệu hóa học: Cl
Số ô nguyên tố: 17
Cấu hình e: 1s22s22p63s23p5
Khối lượng nguyên tử: 35,5
Công thức phân tử: Cl2
Khối lượng phân tử: 71
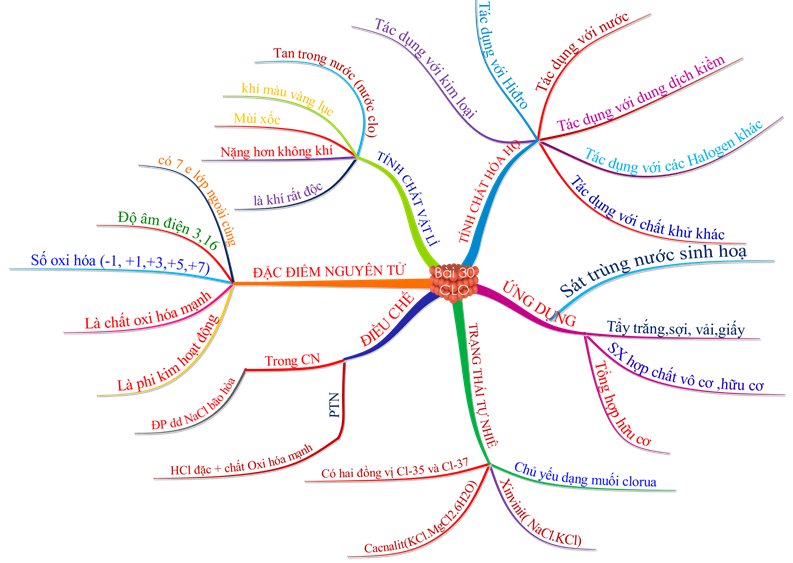
1.2. Tính chất vật lí

Ở điều kiện thường, Clo là chất khí màu vàng lục, mùi xốc, rất độc.
Khí Clo nặng gấp 2,5 lần không khí và tan ít trong nước tạo thành dung dịch nước Clo có màu vàng nhạt , Clo tan nhiều trong các dung môi hữu cơ: Benzen,…
1.3. Tính chất hóa học
Clo thể hiện tính oxi hóa mạnh chỉ kém hơn Flo và Oxi.
Cl + 1e → Cl-
Hay: Cl2 + 2.1e → 2 Cl-
a. Phản ứng với kim loại
Clo tác dụng với kim loại tạo muối Clorua
2M + nCl2 → 2MCln
Natri nóng chảy trong khí Clo nóng chảy trong khí clo với ngọn lửa sáng chói, tạo natri clorua:
2Na + Cl2 → 2NaCl
Video 1: Natri cháy sáng trong khí clo
Dây đồng nung nóng đỏ cháy trong không khí clo tạo thành Đồng (II) clorua
Cu (đỏ) + Cl2 (vàng lục) → CuCl2 (trắng)
Video 2: Đồng tác dụng với khí Clo
Dây sắt nung nóng đỏ cháy trong khí clo tạo thành khói màu nâu là những hạt sắt (III) clorua
2Fe + 3Cl2 → 2FeCl3
Video 3: Sắt tác dụng với khí clo
b. Tác dụng với khí Hidro
Clo tác dụng với khí hidro tạo Khí Hiđro Clorua không màu dễ tan trong nước.
H2 + Cl2 → 2HCl
Kết luận: Trong phản ứng với kim loại và với hiđro thì Clo thể hiện tính oxi hóa mạnh.
c. Tác dụng với nước
Khi tan trong nước một phần Clo phản ứng với nước tạo hỗn hợp hai axit Clohiđric và axit Hypoclorơ.
Video 4: Clo tác dụng với nước
Kết luận: Trong phản ứng với nước, Clo vừa đóng vai trò là chất khử, vừa đóng vai trò là chất oxi hóa.
1.4. Trạng thái tự nhiên
Trong tự nhiên Clo có hai đồng vị bền là \({}^{35}Cl{\rm{ (75,77)}}\)
Clo chủ yếu tồn tại dưới dạng hợp chất NaCl và các chất khoáng.
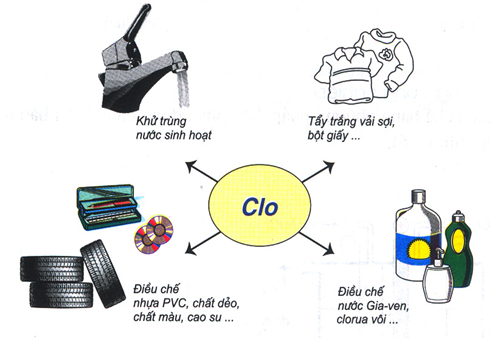
1.5. Ứng dụng
Clo được dùng để tiệt trùng nước sinh họat, dùng để tẩy trắng vải, sợi giấy…
Một lượng lớn Clo dùng để điều chế một số chất hữu cơ như : PVC, CCl4…
Điều chế một số hóa chất quan trọng khác: nước Javen
1.6. Điều chế
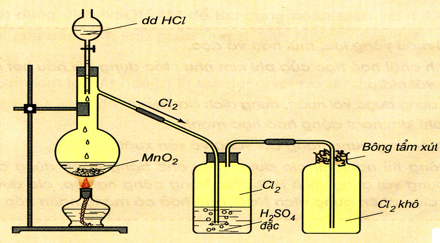
a. Trong phòng thí nghiệm
Dùng chất oxihóa mạnh như MnO2, KMnO4, KClO3,…tác dụng dung dịch HCl đặc hoặc muối Clorua
MnO2 + 4HCl → MnCl2 + Cl2 + H2O
2KMnO4 + 16HCl → 2MnCl2 + + 2KCl + 5Cl2 + 8H2O
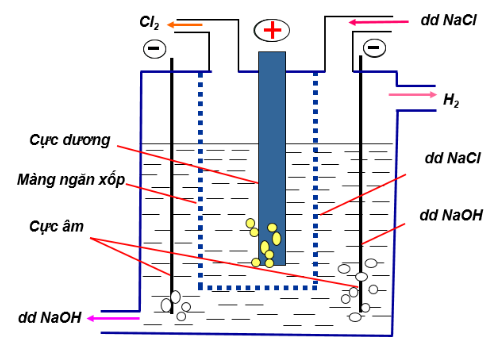
b. Trong công nghiệp
Điện phân dung dịch NaCl có màng ngăn bằng xốp với điện cực dương bằng than chì và điện cực âm làm bằng sắt.
2NaCl +2H2O → 2NaOH + H2 + Cl2
1.7. Tổng kết
2. Bài tập minh họa
2.1. Dạng 1: Lý thuyết về tính chất và cách điều chế clo
Bài 1: Nguyên tố Cl ở ô thứ 17 trong bảng tuần hoàn, cấu hình electron của ion Cl- là :
A. 1s22s22p63s23p4.
B. 1s22s22p63s23p2.
C. 1s22s22p63s23p6.
D. 1s22s22p63s23p5.
Hướng dẫn giải
Cấu hình e của Cl- là: 1s22s22p63s23p6
Đáp án C
Bài 2: Sục Cl2 vào nước, thu được nước clo màu vàng nhạt. Trong nước clo có chứa các chất là:
A. Cl2, H2O.
B. HCl, HClO.
C. HCl, HClO, H2O.
D. Cl2, HCl, HClO, H2O.
Hướng dẫn giải
Ta có phương trinh:
Cl2 + H2O → HCl + HclO
→ Trong nước clo sẽ gồm có: Cl2, HCl, HClO, H2O
Đáp án D
2.2. Dạng 2: Bài toán liên quan đến điều chế clo trong phòng thí nghiệm
Bài 1: Cho 8,7 gam MnO2 tác dụng với dung dịch axit HCl đậm đặc sinh ra V lít khí Cl2 (đktc). Hiệu suất phản ứng là 85%. V có giá trị là :
A. 2 lít.
B. 2,905 lít.
C. 1,904 lít.
D. 1,82 lít.
Hướng dẫn giải
Ta có phương trình hóa học:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O (1)
Từ (1) → nCl2 = n MnO2 = 8,7 : 87 = 0,1 (mol)
H% = 85%
→ n Cl2 sinh ra = 0,1 * H% = 0,085 mol
VCl2 = 0,085 .22,4 = 1,904 lit
Bài 2: Cho một lượng dư KMnO4 vào 25 ml dung dịch HCl thu được 1,4 lít khí (đktc). Vậy nồng độ mol của dung dịch HCl đã dùng là :
A. 8,5M.
B. 8M.
C. 7,5M.
D. 7M.
Hướng dẫn giải
Ta có phương trình:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
n Cl2 = 1,4 : 22,4 = 0,0625 (mol)
→ n HCl = 16/5 n Cl2 = 0,0625 * 16/5 = 0,2 (mol)
→ CM HCl = 0,2 : (25 : 1000) = 8M
2.3. Dạng 3: Bài toán liên quan đến tính chất hóa học khác của clo
Bài 1: Cho 6,72 lít clo (đktc) tác dụng với 22,4 gam Fe nung nóng (hiệu suất phản ứng 100%), lấy chất rắn thu được hoà tan vào nước và khuấy đều thì khối lượng muối trong dung dịch thu được là :
A. 38,10 gam.
B. 48,75 gam.
C. 32,50 gam.
D. 25,40 gam.
Hướng dẫn giải
n Cl2 = 0,3 mol
n Fe = 22,4 : 56 = 0,4 mol
2Fe + 3Cl2 → 2FeCl3
→ Sau phản ứng Clo hết, phản ứng được tính theo clo
→ nFeCl3 = 2/3nCl2 = 0,2 mol
→ m FeCl3 = 0,2.(56 + 35,5.3) = 32,5 gam
Đáp án C
Bài 2: Hỗn hợp khí A gồm clo và oxi. A phản ứng vừa hết với một hỗn hợp gồm 4,8 gam magie và 8,1 gam nhôm tạo ra 37,05 gam hỗn hợp các muối clorua và oxit hai kim loại. Thành phần % thể tích của oxi và clo trong hỗn hợp A là :
A. 26,5% và 73,5%.
B. 45% và 55%.
C. 44,44% và 55,56%.
D. 25% và 75%.
Hướng dẫn giải
Áp dụng định luật bảo toàn khối lượng: mKL + mO2 + mCl2 = mMuối
→ mO2 + mCl2 = 37,05 – 4,8 – 8,1 = 24,15 gam
Áp dụng định luật bảo toàn điện tích
→ 4.nO2 + 2.nCl2 = 2.nMg + 3.nAl = 0,4 + 0,9 = 1,3
Gọi n O2 , nCl2 lần lượt là x, y
Ta có hệ phương trình
→ 32x + 71y = 24,15 và 4x + 2y = 1,3
→ x = 0,2 và y = 0,25
%VO2 = 0,2 : 0,45.100% = 44,44%
% VCl2 = 55,56%
Đáp án C.
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Cho 17,4 gam MnO2 tác dụng với dd HCl đặc, dư và đun nóng. Thể tích khí thoát ra (đktc) là (cho Mn = 55)?
Câu 2: Đốt 16,8g Fe trong bình đựng khí clo. Thể tích khí clo (đktc) tham gia phản ứng là?
Câu 3: Trong phản ứng: Cl2 + 2NaBr → 2NaCl + Br2, clo đóng vai trò gì?
Câu 4: Điện phân dung dịch chứa 5,85 gam NaCl trong điều kiện có màng ngăn, sau phản ứng thu được V lít khí Cl2 ở đktc. Giá trị của V là?
Câu 5: Đốt cháy hết 13,6g hỗn hợp Mg, Fe trong bình khí clo dư, sau phản ứng thấy khối lượng khí clo giảm 28,4 gam. Khối lượng muối clorua khan thu được là?
3.2. Bài tập trắc nghiệm
Câu 1: Vị trí của Cl (z = 17) trong bảng tuần hoàn là
A. ô 17, chu kỳ 3, nhóm VIIA.
B. ô 17, chu kỳ 3, nhóm VA.
C. ô 17, chu kỳ 4, nhóm VIIA.
D. ô 17, chu kỳ 4, nhóm VA.
Câu 2: Cho một luồng khí clo dư tác dụng với 9,2 gam kim loại sinh ra 23,4 gam muối kim loại M hoá trị I. Muối kim loại hoá trị I là muối nào sau đây?
A. NaCl.
B. KCl.
C. LiCl.
D. Kết quả khác
Câu 3: Hòa tan khí Cl2 vào dung dịch KOH đặc, nóng, dư thu được dung dịch chứa các chất thuộc dãy nào sau đây?
A. KCl, KClO3, Cl2
B. KCl, KClO, KOH
C. KCl, KClO3, KOH
D. KCl, KClO3
Câu 4: Để điều chế clo, người ta có thể làm như sau:
A. Điện phân muối NaCl nóng chảy hoặc dung dịch NaCl bão hòa có màng ngăn.
B. Cho KMnO4 hoặc MnO2 tác dụng với dung dịch HCl đặc.
C. Cho KClO3 tác dụng với dung dịch HCl đặc.
D. A hoặc B hoặc C.
Câu 5: Hòa tan khí Cl2 vào dung dịch NaOH loãng, dư ở nhiệt độ phòng thu được dung dịch chứa các chất
A. NaCl, NaClO3, Cl2
B. NaCl, NaClO, NaOH
C. NaCl, NaClO3, NaOH
D. NaCl, NaClO3
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Clo Hóa học 10 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Tính chất vật lí, trạng thái tự nhiên, ứng dụng của clo, phương pháp điều chế clo trong phòng thí nghiệm, trong công nghiệp.
- Tính chất hoá học cơ bản của clo là phi kim mạnh, có tính oxi hoá mạnh (tác dụng với kim loại, hiđro), Clo còn thể hiện tính khử.
Tham khảo thêm
- doc Hoá học 10 Bài 21: Khái quát về nhóm halogen
- doc Hoá học 10 Bài 23: Hiđro clorua - Axit clohiđric và muối clorua
- doc Hoá học 10 Bài 24: Sơ lược về hợp chất có oxi của clo
- doc Hoá học 10 Bài 25: Flo - Brom - Iot
- doc Hoá học 10 Bài 26: Luyện tập Nhóm halogen
- doc Hoá học 10 Bài 27: Bài thực hành số 2 Tính chất hóa học của khí clo và hợp chất của Clo
- doc Hoá học 10 Bài 28: Bài thực hành số 3 Tính chất hóa học của Brom và Iot
