Hoá học 10 Bài 10: Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Nội dung bài học Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học tìm hiểu về Mối quan hệ giữa vị trí (ô) nguyên tố, cấu tạo nguyên tử và tính chất của nguyên tố ở đơn chất và hợp chất. Các kiến thức cơ bản về bảng tuần hoàn và định luật tuần hoàn.
Mục lục nội dung

1. Tóm tắt lý thuyết
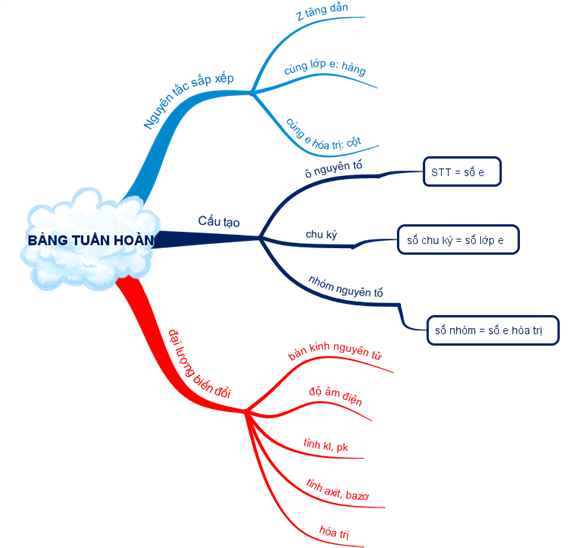
1.1. Quan hệ giữa vị trí và cấu tạo
- Vị trí của một nguyên tố trong bảng tuần hoàn, có thể suy ra:
+ Số đơn vị điện tích hạt nhân
+ Số lớp electron
+ Số electron ở lớp ngoài cùng
- Cấu tạo nguyên tử:
+ Số proton, số electron
+ Số lớp electron
+ Số electron lớp ngoài cùng
1.2. Quan hệ giữa vị trí và tính chất của nguyên tố
Vị trí của một nguyên tố trong bảng tuần hoàn có thể suy ra tính chất hóa học:
- Tính kim loại và phi kim
- Hóa trị cao nhất của nguyên tố đó với oxi, với hiđro (nếu có)
- Oxit, hiđroxit có tính axit hay bazơ.
1.3. So sánh tính chất hóa học của một nguyên tố với các nguyên tố lân cận
- Trong chu kì theo chiều tăng của Z:
+ Tính phi kim tăng dần, tính kim loại yếu dần
+ Oxit và hiđroxit của các nguyên tố có tính bazơ yếu dần đồng thời tính axit tăng dần.
- Trong nhóm A theo chiều tăng dần của Z:
+ Tính kim loại tăng dần, tính phi kim giảm dần.
+ Oxit và hiđroxit của các nguyên tố có tính bazơ tăng dần, tính axit giảm dần.
1.4. Tổng kết
2. Bài tập minh họa
2.1. Dạng 1: Cách xác định tên nguyên tố khi biết thành phần nguyên tố trong hợp chất
Oxit cao nhất của một nguyên tố chứa 72,73% oxi, còn trong hợp chất khí với hidro chứa 75% nguyên tố đó.Viết công thức oxit cao nhất và hợp chất khi với hidro.
Hướng dẫn giải
Gọi hợp chất với hidro có công thức là : RHx
⇒ Hợp chất với oxi có công thức là R2 Ox-8
Ta có:
(1) (2.R) / 16(8-x )= 27,27/72,73.
(2) R/x = 75/ 25 = 3
⇒ R= 3x thay vào pt(1) ta có đáp án : x= 4 và ⇒ R = 12
Vậy R là cacbon ⇒ CO2 và CH4
2.2. Dạng 2: Xác định nguyên tố thông qua nguyên tử khối
Cho 10 gam kim loại A (thuộc nhóm IIA) tác dụng với nước, thu được 6,11 lit khí hiđro (đo ở 25oC và 1 atm).
a. Hãy xác định tên của kim loại M đã dùng.
b. Cho 4 gam kim loại A vào cốc đựng 2,5lit dung dịch HCl 0,06M thu được dung dịch B.
Hướng dẫn giải
A + 2H2O → A(OH)2 + H2
a a
Số mol khí H2 = 0,25 (mol) ⇒ a = 0,25
Ta có: MA = 10/0,25 = 40 (Ca).
b. Số mol Ca = 4/40 = 0,1 mol. Các phương trình phản ứng:
Ca + 2HCl → CaCl2 + H2
(mol): 0,075 0,15 0,075
Ca + 2H2O → Ca(OH)2 + H2
(mol): 0,025 0,025
Dung dịch B gồm: CaCl2 = 0,075 mol và Ca(OH)2 = 0,025 mol.
2.3. Dạng 3: xác định tên nguyên tố dựa vào đặc điểm chu kì, nhóm
Bài 1: A và B là hai nguyên tố ở cùng một nhóm và thuộc hai chu kì liên tiếp trong bảng tuần hoàn. Tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 32. Hãy viết cấu hình electron của A, B và của các ion mà A và B có thể tạo thành.
Hướng dẫn giải
Theo bài ra, tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 32 nên ZA + ZB = 32.
Trường hợp 1: ZB - ZA = 8. Ta tìm được ZA = 12; ZB = 20.
Cấu hình electron:
A : 1s22s22p63s2 (chu kỳ 3, nhóm IIA).
và B: 1s22s22p63s23p64s2 (chu kỳ 4, nhóm IIA).
Ion A2+: 1s22s22p6 và B2+: 1s22s22p63s23p6.
Trường hợp 2: ZB - ZA = 18. Ta tìm được ZA = 7; D = 25.
Cấu hình electron:
A : 1s22s22p3 (chu kỳ 2, nhóm VA).
và B: 1s22s22p63s23p63d54s2 (chu kỳ 4, nhóm VIIB).
Trường hợp này A, B không cùng nhóm nên không thỏa mãn.
Bài 2: Cho 8,8 gam một hỗn hợp hai kim loại nằm ở hai chu kì liên tiếp nhau và thuộc nhóm IIIA, tác dụng với HCl dư thì thu được 6,72 lít khí hidro (đktc). Dựa vào bảng tuần hoàn cho biết tên hai kim loại đó.
Hướng dẫn giải
Kí hiệu hai kim loại nhóm IIIA là M, nguyên tử khối trung bình là M−
Phương trình hóa học có dạng: 2M + HCl → 2MCl2 + 3H2
nH2 = 6,72/22,4 = 0,3 (mol)
nM = 2/3 nH2 = 0,2 (mol)
theo đầu bài: M− .0,2 = 8,8 → M− = 44
hai kim loại thuộc hai chu kì liên tiếp, một kim loại có nguyên tử khối nhỏ hơn 44 và một kim loại có nguyên tử khối lơn hơn 44.
Dựa vào bảng tuần hoàn, hai kim loại đó là:
Al (M = 27 < 44) và Ga (M = 69,72 > 44).
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: R là một nguyên tố phi kim. Tổng đại số số oxi hóa dương cao nhất với 2 lần số oxi hóa âm thấp nhất của R là +2. Tổng số proton và nơtron của R < 34. R là?
Câu 2: A là hỗn hợp 2 kim loại kiềm X và Y thuộc 2 chu kì kế tiếp. Nếu cho A tác dụng vừa đủ với dung dịch HCl thì thu được a gam 2 muối, còn nếu cho A tác dụng vừa đủ với dung dịch H2SO4 thì thu được 1,1807a gam 2 muối. X và Y lần lượt là?
Câu 3: Tính axit của các axit HCl, HBr, HI, H2S được sắp xếp theo trật tự nào?
Câu 4: Hòa tan 20,2 gam hỗn hợp hai kim loại nằm ở hai chu kì liên tiếp thuộc nhóm IA trong bảng tuần hoàn tác dụng với nước thu được 6,72 lít khí (đktc) và dung dịch A. Xác định tên và khối lượng hai kim loại.
3.2. Bài tập trắc nghiệm
Câu 1: X là nguyên tố thuộc nhóm IVA, chu kì 5 của bảng tuần hoàn. Có các phát biểu sau:
(1) X có 4 lớp electron và có 20 electron p.
(2) X có 5 electron hóa trị và 8 electron s.
(3) X có thể tạo được hợp chất bền với oxi có công thức hóa học XO2 và XO3.
(4) X có tính kim loại mạnh hơn so với nguyên tố có số thứ tự 33.
(5) X ở cùng nhóm với nguyên tố có số thứ tự 14.
Trong các phát biểu trên, số phát biểu đúng là
A. 2
B. 3
C. 4
D. 5
Câu 2: Cho ba nguyên tố X, Y, Z lần lượt ở vị trí 11, 12, 19 của bảng tuần hoàn. Hidroxit của X, Y, Z tương ứng là X’, Y’, Z’.
Thứ tự tăng dần tính bazơ của X’, Y’, Z’ là
A. X’ < Y’ < Z’
B. Y’ < X’ < Z’
C. Z’ < Y’ < X’
D. Z’ < X’ < Y’
Câu 3: Phát biểu nào sau đây không đúng?
A. Trong số các nguyên tố bền, cesi là kim loại mạnh nhất.
B. Trong nhóm IVA vừa có nguyên tố kim loại, vừa có nguyên tố phi kim.
C. Tất cả các nguyên tố nhóm B đều là kim loại.
D. Đối với tất cả nguyên tố thuộc nhóm A của bảng tuần hoàn, số electron lớp ngoài cùng bằng số thứ tự nhóm.
Câu 4: Một nguyên tố Y đứng liền trước nguyên tố X trong cùng một chu kì của bảng tuần hoàn. Y đứng liền trước Z trong cùng một nhóm A. Phát biểu nào sau đây là đúng?
A. Số hiệu nguyên tử theo thứ tự tăng dần là X < Y < Z.
B. Bán kính nguyên tử theo thứ tự tăng dần là Z < Y < X.
C. Hóa trị cao nhất trong hợp chất với oxi tăng dần theo thứ tự: Z < Y < X.
D. Trong các hidroxit, tính axit tăng dần theo thứ tự: hidroxit của Z < hidroxit của Y < hidroxit của X.
Câu 5: Dãy nguyên tố nào sau đây có tính chất hóa học tương tự nhau?
A. 11X, 11Y, 11Z
B. 11X, 11Y, 11Z
C. 11X, 11Y, 11Z
D. 11X, 11Y, 11Z
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học Hóa học 10 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Mối quan hệ giữa vị trí (ô) nguyên tố, cấu tạo nguyên tử và tính chất của nguyên tố ở đơn chất và hợp chất.
- Các kiến thức cơ bản về bảng tuần hoàn và định luật tuần hoàn.
Tham khảo thêm
- doc Hoá học 10 Bài 7: Bảng tuần hoàn các nguyên tố hóa học
- doc Hoá học 10 Bài 8: Sự biến đổi tuần hoàn cấu hình electron nguyên tử của các nguyên tố hóa học
- doc Hoá học 10 Bài 9: Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học và Định luật tuần hoàn
- doc Hoá học 10 Bài 11: Luyện tập Bảng tuần hoàn, sự biến đổi tuần hoàn cấu hình electron nguyên tử và tính chất của các nguyên tố hóa học
