Giải bài tập SGK Hóa 10 Bài 16: Luyện tập Liên kết hóa học
Để các em có thêm nhiều tài liệu tham khảo hữu ích chúng tôi xin giới thiệu đến các em học sinh nội dung giải bài tập SGK môn Hóa học 10 dưới đây. Tài liệu được eLib biên soạn và tổng hợp với nội dung các bài tập có phương pháp và hướng dẫn giải đầy đủ chi tiết, rõ ràng. Mời các em cùng tham khảo.
Mục lục nội dung
1. Giải bài 1 trang 76 SGK Hóa học 10
2. Giải bài 2 trang 76 SGK Hóa học 10
3. Giải bài 3 trang 76 SGK Hóa học 10
4. Giải bài 4 trang 76 SGK Hóa học 10
5. Giải bài 5 trang 76 SGK Hóa học 10
6. Giải bài 6 trang 76 SGK Hóa học 10
7. Giải bài 7 trang 76 SGK Hóa học 10

1. Giải bài 1 trang 76 SGK Hóa học 10
a) Viết phương trình biểu diễn sự hình thành các ion sau đây từ các nguyên tử tương ứng:
Na → Na+ ; Cl → Cl-
Mg → Mg2+ ; S → S2-
Al → Al3+ ; O → O2-
b) Viết cấu hình electron của các nguyên tử và các ion. Nhận xét về cấu hình electron lớp ngoài cùng của các ion được tạo thành.
Phương pháp giải
- Biểu diễn quá trình cho nhận các chất
- Viết cấu hình electron của tất cả các nguyên tử và ion
Hướng dẫn giải
a) Na → Na+ +1e ; Cl +1e→ Cl-
Mg → Mg2+ +2e ; S + 2e → S2-
Al → Al3+ +3e ; O +2e → O2-
b) Cấu hình electron của các nguyên tử và các ion:
11Na: 1s22s22p63s1
Na+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
17Cl: 1s22s22p63s23p5
Cl - : 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
12Mg: 1s22s22p63s2
Mg2+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
16S: 1s22s22p63s23p4
S2- : 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
13Al: 1s22s22p63s23p51
Al3+ : 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
8O: 1s22s22p4
O2-: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
2. Giải bài 2 trang 76 SGK Hóa học 10
Trình bày sự giống và khác nhau của 3 loại liên kết: Liên kết ion, liên kết cộng hóa trị không cực và liên kết cộng hóa trị có cực.
Phương pháp giải
Dựa vào kiến thức về liên kết ion, liên kết cộng hóa trị không cực và liên kết cộng hóa trị có cực để phân biệt các chất
Hướng dẫn giải
Sự giống nhau của 3 loại liên kết là: Các nguyên tử kết hợp với nhau để tạo ra cho mỗi nguyên tử lớp electron ngoài cùng bền vững giống cấu trúc khí hiếm (2e hoặc 8e).
Sự khác nhau giữa 3 loại liên kết:
- Liên kết ion:
- Liên kết được hình thành do sự cho và nhận electron.
- Tạo thành từ kim loại và phi kim.
- Liên kết cộng hóa trị không có cực:
- Liên kết được hình thành do sự dùng chung e, cặp e không bị lệch.
- Hình thành giữa các nguyên tử của cùng một nguyên tố phi kim.
- Liên kết cộng hóa trị có cực:
- Liên kết được hình thành do sự dùng chung e, cặp e bị lệch về phía nguyên tử có độ âm điện mạnh hơn.
- Hình thành giữa phi kim mạnh và yếu khác.
⇒ Nhận xét: Liên kết cộng hóa trị có cực là dạng trung gian giữa liên kết cộng hóa trị không cực và liên kết ion
3. Giải bài 3 trang 76 SGK Hóa học 10
Cho dãy oxit sau đây: Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7.
Dựa vào giá trị hiệu độ âm điện của 2 nguyên tử trong phân tử hãy xác định loại liên kết trong từng phân tử oxit ( tra giá trị độ âm điện ở bảng 6, trang 45).
Phương pháp giải
Lấy độ âm điện của nguyên tử có độ âm điện lớn trừ đi độ âm điện của nguyên tử nhỏ nếu:
Hiệu độ âm điện < 0,4 → liên kết CHT không phân cực
Hiệu độ âm điện từ 0,4 đến < 1,7 → liên kết CHT có cực
Hiệu độ âm điện ≥ 1,7 → liên kết ion
Hướng dẫn giải
Na2O: 2,51 ⇒ liên kết ion.
MgO: 2,13 ⇒ liên kết ion.
Al2O3: 1,83 ⇒ liên kết ion.
SiO2: 1,54 ⇒ liên kết cộng hóa trị có cực.
P2O5: 1,25 ⇒ liên kết cộng hóa trị có cực.
SO3: 0,86 ⇒ liên kết cộng hóa trị có cực.
Cl2O7: 0,28 ⇒ liên kết cộng hóa trị không cực.
4. Giải bài 4 trang 76 SGK Hóa học 10
a) Dựa vào giá trị độ âm điện ( F: 3,98 ; O: 3,44 ; Cl: 3,16 ; N: 3,04) hãy xét xem tính phi kim thay đổi như thế nào của dãy nguyên tố sau: F, O, N, Cl.
b) Viết công thức cấu tạo của các phân tử sau đây: N2, CH4, H2O, NH3
Xét xem phân tử nào có liên kết không phân cực, liên kết phân cực mạnh nhất.
Phương pháp giải
a) Xác định độ âm điện của các chất N2, CH4, H2O, NH3
- Dựa vào độ âm điện để nhận xét
b) Phân tử N2, CH4 có liên kết cộng hóa trị không phân cực.
- Phân tử H2O có liên kết cộng hóa trị phân cực mạnh nhất trong dãy.
Hướng dẫn giải
F O Cl N
Độ âm điện: 3,98 3,44 3,16 3,14
Nhận xét: độ âm điện giảm dần, tính phi kim giảm dần ( vì độ âm điện đặc trưng cho khả năng hút em electron về phía nguyên tử đó)
b)
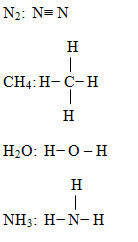
N2 CH4 H2O NH3
Hiệu độ âm điện: 0 0,35 1,24 0,84
Phân tử N2, CH4 có liên kết cộng hóa trị không phân cực.
Phân tử H2O có liên kết cộng hóa trị phân cực mạnh nhất trong dãy.
5. Giải bài 5 trang 76 SGK Hóa học 10
Một nguyên tử có cấu hình electron 1s22s22p3
a) Xác định vị trí của nguyên tố đó trong bảng tuần hoàn, suy ra công thức phân tử của hợp chất khí với hiđro
b) Viết công thức electron và công thức cấu tạo của phân tử đó.
Phương pháp giải
- Tổng số electron → số thứ tự của nguyên tố
- Số lớp electron → chu kì
- Số e ngoài cùng → nhóm
Hướng dẫn giải
a)
- Tổng số electron là = 2+ 2+ 3 = 7 → số thứ tự của nguyên tố là 7.
- Có 2 lớp electron → nguyên tố ở chu kì 2.
- Nguyên tố p có 5 electron ở lớp ngoài cùng nên thuộc nhóm VA. Đó là nitơ. Công thức phân tử hợp chất với hiđro là NH3
b) Công thức electron và công thức cấu tạo của phân tử NH3

6. Giải bài 6 trang 76 SGK Hóa học 10
a) Lấy ví dụ về tinh thể ion, tinh thể nguyên tử, tinh thể phân tử.
b) So sánh nhiệt độ nóng chảy của các loại tinh thể đó. Giải thích.
c) Tinh thể nào dẫn điện được ở trạng thái rắn? Tinh thể nào dẫn điện được khi nóng chảy và khi hòa tan trong nước?
Phương pháp giải
- Dựa vào lý thuyết đã học về tinh thể để giải quyết bài toán
- So sánh nhiệt độ nóng chảy của chất dựa vào lực liên kết.
Hướng dẫn giải
a) Tinh thể ion: Nacl; MgO; CsBr; CsCl
Tinh thể nguyên tử: Kim cương
Tinh thể phân tử: Băng phiến, iot, nước đá, cacbon đioxit
b) So sánh nhiệt độ nóng chảy:
Lực hút tĩnh điện giữa các ion ngược dấu lớn nên tinh thể ion rất bền vững. Các hợp chất ion đều khá rắn,khó bay hơi,khó nóng chảy
- Lực liên kết cộng hóa trị trong tinh thể nguyên tử rất lớn, vì vậy tinh thể nguyên tử đều bền vững, khá cứng, khó nóng chảy, khó bay hơi.
- Trong tinh thể phân tử các phân tử hút nhau bằng lực tương tác yếu giữa các phân tử. Vì vậy tinh thể phân tử dễ nóng chảy, dễ bay hơi
c) Không có tinh thể nào có thể dẫn điện ở trạng thái rắn.
Tinh thể dẫn điện được nóng chảy và khi hòa tan trong nước là: tinh thể ion
7. Giải bài 7 trang 76 SGK Hóa học 10
Xác định điện hóa trị của các nguyên tố nhóm VIA, VIIA trong các hợp chất với các nguyên tố nhóm IA.
Phương pháp giải
- Các nguyên tố kim loại thuộc nhóm IA có số electron ở lớp ngoài cùng là 1
- Các nguyên tố phi kim thuộc nhóm VIA, VIIA có 6, 7 electron ở lớp ngoài cùng
Từ đó xác định điện hóa trị
Hướng dẫn giải
Điện hóa trị của các nguyên tố nhóm VIA, VIIA trong các hợp chất với các nguyên tố nhóm IA là:
Các nguyên tố kim loại thuộc nhóm IA có số electron ở lớp ngoài cùng là 1, có thể nhường 1 electron này nên điện hóa trị là +1
Các nguyên tố phi kim thuộc nhóm VIA, VIIA có 6, 7 electron ở lớp ngoài cùng, có thể nhận thêm 2 hay 1 electron vào lớp ngoài cùng nên có điện hóa trị 2- hoặc 1-
8. Giải bài 8 trang 76 SGK Hóa học 10
a) Dựa vào vị trí của các nguyên tố trong bảng tuần hoàn, hãy nêu rõ trong các nguyên tố sau đây những nguyên tố nào có cùng cộng hóa trị trong các oxit cao nhất:
Si, P, Cl, S, C,N, Se, Br.
b) Những nguyên tố nào sau đây có cùng cộng hóa trị trong các hợp chất khí với hidro
P, S, F, Si, Cl, N, As, Te.
Phương pháp giải
- Để xác định nguyên tố cùng cộng hóa trị → nằm trong cùng 1 nhóm
Hướng dẫn giải
a) Những nguyên tố có cùng cộng hóa trị trong các oxit cao nhất
RO2 R2O5 RO3 R2O7
Si, C P,N S, Se Cl, Br
b) Những nguyên tố có cùng cộng hóa trị trong hợp chất khí với hidro :
RH4 RH3 RH2 RH
Si N, P, As S, Te F, Cl
9. Giải bài 9 trang 76 SGK Hóa học 10
Xác định số oxi hóa của Mn, Cr, Cl, P, S, C, Br :
a) Trong phân tử KMnO4, Na2Cr2O7, KClO3, H3PO4
b) Trong ion: \({NO_{3}}^{-}\), \({SO_{4}}^{2-}\), \({CO_{3}}^{2-}\), \({Br}^{-}\), \({NH_{4}}^{+}\)
Phương pháp giải
Ghi nhớ 4 quy tắc xác định số oxi hóa sgk hóa 10 - trang 73 để xác định được số oxi hóa của các nguyên tố chính xác
Hướng dẫn giải
a. Trong phân tử
KMnO4: 1 + x + 4.(-2) = 0 → x = 7 →Mn có số oxi hóa +7 trong phân tử KMnO4
Na2Cr2O7: 2.1 + 2.x + 7.(-2) = 0 → x = 6 → Cr có số oxi hóa +6 trong phân tử Na2Cr2O7
KClO3: 1 + x + 3.(-2) = 0 → x = +5 → Cl có số oxi hóa +5 trong hợp chất KClO3
H3PO4: 3.1 + x + 4.(-2) = 0 → x = 5 \( \to\) x = 5 → P có số oxi hóa +5 trong hợp chất H3PO4
b. Trong ion:
NO3-: x + 3.(-2) = -1 → x = 5 → N có số oxi hóa là +5 trong hợp chất NO3-
CO32-: x + 3.(-2) = -2 → x = 4 → C có số oxi hóa là +4
Br-: Br có số oxi hóa là -1
NH4+: x + 4.1 = 1 → x = -3 → N có số oxi hóa là -3
