Giải bài tập SGK Hóa 10 Bài 38: Cân bằng hóa học
Bài này sẽ giúp các em nắm vững được lý thuyết cũng như cách giải các bài tập của bài Cân bằng hóa học với cách làm đầy đủ, chi tiết và rõ ràng. Hy vọng đây sẽ là tài liệu tham khảo hữu ích cho các em học sinh.
Mục lục nội dung

1. Giải bài 1 trang 162 SGK Hóa học 10
Ý nào sau đây là đúng:
A. Bất cứ phản ứng nào cũng phải đạt đến trạng thái cân bằng hóa học.
B. Khi phản ứng thuận nghịch ở trạng thái cân bằng thì phản ứng dừng lại.
C. Chỉ có những phản ứng thuận nghịch mới có trạng thái cân bằng hóa học.
D. Ở trạng thái cân bằng, khối lượng các chất ở hai vế của phương trình phản ứng phải bằng nhau.
Phương pháp giải
Dựa vào nôi dung bài học, phân tích từng nhận định để rút ra nhận định đúng
Hướng dẫn giải
A. Sai vì không phải phản ứng nào cũng phải đạt đến trạng thái cân bằng.
B. Sai vì khi phản ứng thuận nghịch ở trạng thái cân bằng thì tốc độ phản ứng thuận bằng với tốc độ phản ứng nghịch nhưng phản ứng vẫn tiếp tục xảy ra.
D. Sai vì khi ở trạng thái cân bằng khối lượng các chất ở hai vế của phương trình có thể khác nhau.
Đáp án C
2. Giải bài 2 trang 162 SGK Hóa học 10
Hệ cân bằng sau được thực hiện trong bình kín:
2SO2 (k) + O2(k) → 2SO3 (k) ∆H < 0
Yếu tố nào sau đây không làm nồng độ các chất trong hệ cân bằng biến đổi?
A. Biến đổi nhiệt độ.
B. Biến đổi áp suất.
C. Sự có mặt chất xúc tác.
D. Biến đổi dung tích của bình phản ứng.
Phương pháp giải
Nhiệt độ, nồng độ, áp suất và chất xúc tác, là một trong các yếu tố ảnh hưởng tới sự dịch chuyển cân bằng hóa học.
Hướng dẫn giải
Chất xúc tác làm tăng tốc độ phản ứng thuận và tốc độ phản ứng nghịch với số lần bằng nhau. Do vậy, chất xúc tác không làm chuyển dịch cân bằng hóa học hay không làm nồng độ các chất trong cân bằng biến đổi.
Đáp án C
3. Giải bài 3 trang 163 SGK Hóa học 10
Cân bằng hóa học là gì? Tại sao nói cân bằng hóa học là cân bằng động?
Phương pháp giải
Dựa vào phần lý thuyết SGK đề trả lời câu hỏi
Hướng dẫn giải
- Cân bằng hóa học là trạng thái của phản ứng thuân nghịch khi tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
- Cân bằng hóa học là cân bằng động vì: ở trạng thái cân bằng không phải là phản ứng dừng lại, mà là phản ứng thuận và phản ứng nghịch vẫn xảy ra, nhưng tốc độ bằng nhau (vt = vn). Điều này có nghĩa là trong một đơn vị thời gian số mol chất phản ứng giảm đi bao nhiêu theo phản ứng thuận lại được tạo ra bấy nhiêu theo phản ứng nghịch. Do đó cân bằng hóa học là cân bằng động.
4. Giải bài 4 trang 163 SGK Hóa học 10
Thế nào là sự chuyển dịch cân bằng? Những yếu tố nào ảnh hưởng đến cân bằng hóa học? Chất xúc tác có ảnh hưởng đến cân bằng hóa học không? Vì sao?
Phương pháp giải
Dựa vào phần lý thuyết SGK đề trả lời câu hỏi
Hướng dẫn giải
- Sự chuyển dịch cân bằng hóa học là sự di chuyển từ trạng thái cân bằng này sang trạng thái cân bằng khác do tác động của các yếu tố từ bên ngoài lên cân bằng.
- Những yếu tố làm chuyển dịch cân bằng là nồng độ, áp suất và nhiệt độ.
- Chất xúc tác không có ảnh hưởng đến cân bằng hóa học, vì chất xúc tác không làm biến đổi nồng độ các chất trong cân bằng và cũng không làm biến đổi hằng số cân bằng. Chất xúc tác làm tăng tốc độ phản ứng thuận và tốc độ phản ứng nghịch với số lần bằng nhau, nên nó có tác dụng làm cho phản ứng thuận nghịch đạt tới trạng thái cân bằng nhanh chóng hơn.
5. Giải bài 5 trang 163 SGK Hóa học 10
Phát biểu nguyên lí Lơ Sa-tơ-li-ê và dựa vào cân bằng sau để minh họa :
C(r) + CO2(k) → 2CO(k) ∆H > 0
Phương pháp giải
Học sinh cần nắm được nguyên lí chuyển dịch cân bằng Lơ Sa-tơ-li-ê để giải bài.
Hướng dẫn giải
Nguyên lí Lơ Sa-tơ-li-ê:
Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động bên ngoài, như biến đổi nồng độ, áp suất, nhiệt độ, sẽ chuyển dịch câng bằng theo chiều làm giảm tác động bên ngoài đó.
Ví dụ minh họa:
C(r) + CO2(k) → 2CO(k) ∆H > 0
- Nồng độ: Khi ta cho thêm vào một lượng khí CO2 nồng độ trong hệ sẽ tăng lên làm cho cân bằng chuyển dịch theo chiều thuận tức là phản ứng chuyển dịch theo chiều làm giảm nồng độ CO2.
- Nhiệt độ: Khi ta tăng nhiệt độ thấy cân bằng chuyển dịch theo chiều thuận tức là phản ứng chuyển dịch theo chiều thu nhiệt.
- Áp suất: Khi ta tăng áp suất của hệ thấy cân bằng chuyển dịch theo chiều nghịch tức là cân bằng chuyển dịch theo chiều làm giảm số mol phân tử khí (giảm áp suất).
6. Giải bài 6 trang 163 SGK Hóa học 10
Xét các hệ cân bằng sau trong một bình kín:
C(r) + H2O(k) → CO(k) + H2(k); ∆H > 0. (1)
CO(k) + H2O(k) → CO2(k) + H2(k); ∆H < 0. (2)
Các cân bằng trên chuyển dịch như thế nào khi biến đổi trong một các điều kiện sau?
a) Tăng nhiệt độ.
b) Thêm hơi nước vào.
c) Thêm khí H2 vào.
d) Tăng áp suất chung bằng cách nén cho thể tích hệ giảm xuống.
e) Dùng chất xúc tác.
Phương pháp giải
Dựa vào nguyên lí chuyển dịch cân bằng Lơ Sa-tơ-li-ê để xác định chiều chuyển dịch của cân bằng khi ta thay đổi các yếu tố của hệ cân bằng.
Hướng dẫn giải
a) C (r) + H2O (k) → CO (k) + H2 (k); (∆H > 0)
b) CO (k) + H2O (k) → CO2 (k) + H2 (k); (∆H < 0)
Dựa vào nguyên lí chuyển dịch ta có:
- Tăng nhiệt độ phản ứng xảy ra theo chiều thu nhiệt và ngược lại.
- Thêm lượng chất (tăng nồng độ) phản ứng chuyển dịch theo chiều làm giảm nồng độ chất đó và ngược lại.
- Tăng áp suất phản ứng chuyển dịch theo chiều làm giảm áp suất (làm giảm số mol phân tử khí) và ngược lại.
- Xúc tác không ảnh hưởng tới chuyển dịch cân bằng.
Như vậy ta có bảng sau:
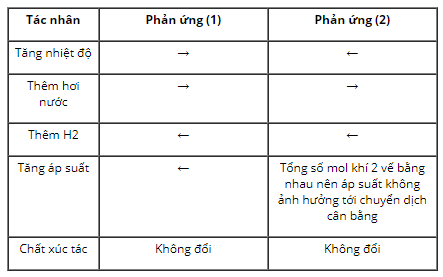
7. Giải bài 7 trang 163 SGK Hóa học 10
Clo phản ứng với nước theo phương trình hóa học sau :
Cl2 + H2O ⇔ HClO + HCl
Dưới tác dụng của ánh sáng, HClO bị phân hủy theo phản ứng :
2HClO → 2HCl + O2 ↑
Giải thích tại sao nước clo (dung dịch clo trong nước) không bảo quản được lâu.
Phương pháp giải
Phản ứng: Cl2 + O2 ⇔ HCl + HClO (không bền)
Hướng dẫn giải
Do HClO không bền dưới ánh sáng nên bị phân hủy hoàn toàn tạo thành HCl và O2. Khi đó nồng độ HClO giảm, phản ứng chuyển dịch theo chiều thuận, Cl2 phản ứng với H2O từ từ cho tới hết, HClO cũng bị phân hủy dần đến hết. Do đó, nước clo không bảo quản được lâu.
8. Giải bài 8 trang 163 SGK Hóa học 10
Cho biết phản ứng sau: 4CuO(r) ⇔ 2Cu2O(r) + O2(k) (∆H > 0)
Có thể dùng những biện pháp gì để tăng hiệu suất chuyển hóa CuO thành Cu2O?
Phương pháp giải
Để tăng hiệu suất chuyển hóa người ta có thể tăng nhiệt độ hoặc giảm áp suất
Hướng dẫn giải
Để tăng hiệu suất chuyển hóa CuO thành Cu2O tức là làm cân bằng chuyển dịch theo chiều thuận:
- Tăng nhiệt độ vì phản ứng thuận là phản ứng thu nhiệt.
- Hút khí O2 ra nhằm để giảm áp suất
