Giải bài tập SGK Hóa 10 Bài 17: Phản ứng oxi hóa khử
Để các em có thêm nhiều tài liệu tham khảo hữu ích chúng tôi xin giới thiệu đến các em học sinh nội dung giải bài tập SGK môn Hóa học 10 dưới đây. Tài liệu được eLib biên soạn và tổng hợp với nội dung các bài tập có phương pháp và hướng dẫn giải đầy đủ chi tiết, rõ ràng. Mời các em cùng tham khảo.
Mục lục nội dung

1. Giải bài 1 trang 82 SGK Hóa học 10
Cho các phản ứng sau:
A. 2HgO → 2Hg + O2
B. СаСОз → CaO + CO2.
C. 2Al(OH)3 → Al2O3 + 3H2O
D. 2NaHCO3 → Na2CO3 + CO2 + H2O
Phản ứng nào là phản ứng oxi hoá - khử.
Phương pháp giải
Phản ứng oxi hóa khử là phản ứng hóa học trong đó đồng thời xảy ra sự oxi hóa và sự khử. Tức số oxi hóa của các chất trước và sau phản ứng thay đổi.
Hướng dẫn giải
Những phản ứng theo đề bài cho, phản ứng oxi hóa khử là
2HgO → 2Hg + O2
Hg2+ + 2e → Hg0
2O2- → O2 + 4e
Còn các phản ứng khác không phải là phản ứng oxi hóa khử
2. Giải bài 2 trang 82 SGK Hóa học 10
Cho các phản ứng sau :
A. 4NH3 + 5O2 → 4NO + 6H2O
B. 2NH3 + 3Cl2 → N2 + 6HCl
C. NH3 + 3CuO → 3Cu + N2 + 3H2O
D. 2NH3 + H2O2 + MnSO4 → MnO2 + (NH4)2SO4.
Ở phản ứng nào NH3 không đóng vai trò chất khử ?
Phương pháp giải
NH3 đóng vai trò là chất khử khi số oxi hóa của NH3 tăng sau phản ứng → các phản ứng còn lại NH3
sẽ đóng vai trò là chất oxi hóa
Hướng dẫn giải
A,B,C số oxi hóa của NH3 đều tăng sau phản ứng → đóng vai trò là chất khử
→ ở phản ứng D NH3 đóng vai trò là môi trường
Đáp án D
3. Giải bài 3 trang 83 SGK Hóa học 10
Trong số các phản ứng sau :
A. HNO3 + NaOH → NaNO3 + H2O
B. N2O5+ H2O → 2HNO3
C. 2HNO3 + 3H2S → 3S + 2NO + 4H2O
D. 2Fe(OH)3 → Fe2O3 + 3H2O.
Phản ứng nào là phản ứng oxi hoá - khử.
Phương pháp giải
Phản ứng oxi hóa khử là phản ứng hóa học trong đó đồng thời xảy ra sự oxi hóa và sự khử( tức các chất có sự thay đổi số oxi hóa trước và sau phản ứng) → tìm ra được phản ứng oxi hóa khử.
Hướng dẫn giải
Trong các phản ứng trên chi có phản ứng C là phản ứng oxi hoá - khử vì có sự thay đổi số oxi hoá của các nguyên tố.
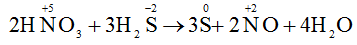
Đáp án C
4. Giải bài 4 trang 83 SGK Hóa học 10
Trong phản ứng : 3NO2 + H2O → 2HNO3 + NO
NO2 đóng vai trò gì ?
A. Chỉ là chất oxí hoá.
B. Chỉ là chất khử.
C. Là chất oxi hoá, nhưng đồng thời cũng là chất khử.
D. Không là chất oxi hoá, không là chất khử.
Chọn đáp án đúng.
Phương pháp giải
Viết phương trình oxi hóa khử
Hướng dẫn giải
NO2 đóng vai trò vừa là chất oxi hoá vừa là chất khử
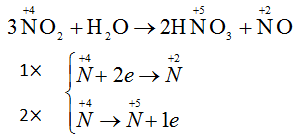
Đáp án C
5. Giải bài 5 trang 83 SGK Hóa học 10
Phân biệt chất oxi hoá và sự oxi hoá, chất khử và sự khử. Lấy thí dụ để minh họa.
Phương pháp giải
Xem lại lý thuyết về phản ứng oxh - khử
Hướng dẫn giải
Chất oxi hoá là chất nhận electron.
Sự oxi hoá một chất là làm cho chất đó nhường electron.
Chất khử là chất nhường electron.
Sự khử một chất là sự làm cho chất đó thu electron.
Thí dụ: Fe + CuSO4 → FeSO4 + Cu
- Nguyên tử Fe nhường electron, là chất khử. Sự nhường electron của Fe được gọi là sự oxi hoá nguyên tử sắt.
- Ion đồng nhận electron, là chất oxi hoá. Sự nhận electron của ion đồng được gọi là sự khử ion đồng.
6. Giải bài 6 trang 83 SGK Hóa học 10
Thế nào là phản ứng oxi hoá - khử ? Lấy ba thí dụ.
Phương pháp giải
Xem lại lý thuyết về phản ứng oxh - khử
Hướng dẫn giải
Phản ứng oxi hoá - khử là phản ứng hoá học trong đó có sự chuyển electron giữa các chất phản ứng.
Thí dụ:
\(\begin{array}{l}
\mathop {{H_2}}\limits^0 + \mathop {C{l_2}}\limits^0 \to 2\mathop H\limits^{ + 1} \mathop {Cl}\limits^{ - 1} \\
\mathop {Fe}\limits^0 + 2\mathop H\limits^{ + 1} Cl \to \mathop {Fe}\limits^{ + 2} C{l_2} + \mathop {{H_2}}\limits^0 \\
2FeC{l_2} + \mathop {C{l_2}}\limits^0 \to 2\mathop {Fe}\limits^{ + 3} \mathop {C{l_3}}\limits^{ - 1}
\end{array}\)
7. Giải bài 7 trang 83 SGK Hóa học 10
Lập phương trình phản ứng oxi hoá - khử sau đây theo phương pháp thăng bằng electron :
a) Cho MnO2 tác dụng với dung dịch axit HCl đặc, thu được MnCl2, Cl2 và H2O.
b) Cho Cu tác dụng với dung dịch axit HNO3 đặc, nóng thu được Cu(NO3)2, NO2 và H2O.
c) Cho Mg tác dụng với dung dịch axit H2SO4 đặc, nóng thu được MgSO4, S và H2O.
Phương pháp giải
- Lập PTHH
- Xác định số oxi hóa
- Viết quá trình oxi hóa khử
- Tìm hệ số thích hợp
Hướng dẫn giải
a. \(\begin{array}{l}
\mathop {Mn}\limits^{ + 4} {O_2} + 4H\mathop {C{l_d}}\limits^{ - 1} \to \mathop {Mn}\limits^{ + 2} C{l_2} + \mathop {C{l_2}}\limits^0 + 2{H_2}O\\
\left\{ \begin{array}{l}
\mathop {Mn}\limits^{ + 4} + 2e \to \mathop {Mn}\limits^{ + 2} \\
2\mathop {Cl}\limits^{ - 1} \to C{l_2} + 2e
\end{array} \right.
\end{array}\)
b. \(\begin{array}{l}
\mathop {Cu}\limits^0 + 4H\mathop N\limits^{ + 3} {O_{3\;d}} \to \mathop {Cu}\limits^{ + 2} {(N{O_3})_2} + 2\mathop N\limits^{ + 4} {O_2} + 2{H_2}O\\
\begin{array}{*{20}{c}}
{1 \times }\\
\;\\
{1 \times }
\end{array}\left\{ {\begin{array}{*{20}{c}}
{\mathop {Mn}\limits^{ + 4} + 2e \to \mathop {Mn}\limits^{ + 2} }\\
\;\\
{2\mathop {Cl}\limits^{ - 1} \to C{l_2} + 2e}
\end{array}} \right.
\end{array}\)
c. \(\begin{array}{l}
3\mathop {Mg}\limits^0 + 4{H_2}\mathop S\limits^{ + {6^0}} {O_4}3\mathop {Mg}\limits^{ + 2} S{O_4} + \mathop S\limits^0 \downarrow + 4{H_2}O\\
\begin{array}{*{20}{c}}
{3 \times }\\
\;\\
{1 \times }
\end{array}\left\{ {\begin{array}{*{20}{c}}
{\mathop {Mg}\limits^0 \to \mathop {Mg}\limits^{ + 2} + 2e}\\
\;\\
{\mathop S\limits^{ + 6} + 6e \to \mathop S\limits^0 \;\;\;\;}
\end{array}} \right.
\end{array}\)
8. Giải bài 8 trang 83 SGK Hóa học 10
Cần bao nhiêu gam đồng để khử hoàn toàn lượng ion bạc có trong 85 ml dung dịch AgNO3 0,15M ?
Phương pháp giải
Bước 1: đổi số mol AgNO3
Bước 2: Viết PTHH xảy ra: Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Bước 3: tính toán số mol Cu theo số mol của AgNO3
Hướng dẫn giải
\( n_{AgNO_{3}}\) = \( \dfrac{0,15.85}{1000}\) = 0,01275 mol
Phương trình hoá học của phản ứng :
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
1mol 2mol
x mol ← 0,01275 mol
x = \( \dfrac{0,01275}{2}\) = 0,006375 mol
mCu tham gia phản ứng : 0,006375 X 64 = 0,408 g.
