Giải bài tập SGK Hóa 10 Bài 18: Phân loại phản ứng trong hóa học vô cơ
Để các em có thêm nhiều tài liệu tham khảo hữu ích chúng tôi xin giới thiệu đến các em học sinh nội dung giải bài tập SGK môn Hóa học 10 dưới đây. Tài liệu được eLib biên soạn và tổng hợp với nội dung các bài tập có phương pháp và hướng dẫn giải đầy đủ chi tiết, rõ ràng. Mời các em cùng tham khảo.
Mục lục nội dung
1. Giải bài 1 trang 86 SGK Hóa học 10
2. Giải bài 2 trang 86 SGK Hóa học 10
3. Giải bài 3 trang 86 SGK Hóa học 10
4. Giải bài 4 trang 86 SGK Hóa học 10
5. Giải bài 5 trang 87 SGK Hóa học 10
6. Giải bài 6 trang 87 SGK Hóa học 10
7. Giải bài 7 trang 87 SGK Hóa học 10

1. Giải bài 1 trang 86 SGK Hóa học 10
Cho phản ứng : 2Na + Cl2 → 2NaCl
Trong phản ứng này, nguyên tử natri
A. bị oxi hoá.
B. bị khử.
C. vừa bị oxi hoá, vừa bị khử.
D. không bị oxi hoá, không bị khử.
Chọn đáp án đúng.
Phương pháp giải
Xác định số oxi hóa của Na trước và sau phản ứng.
Nếu số oxi hóa tăng → Na đóng vai trò là chất khử
Nếu số oxi hóa giảm → Na đóng vai trò là chất oxi hóa
Hướng dẫn giải
\(\mathop {Na\,}\limits^0 + \,C{l_{2\,}}\xrightarrow{{}}2\mathop {Na}\limits^{ + 1} Cl\)
→ Na đóng vai trò là chất khử
Đáp án đúng là A
2. Giải bài 2 trang 86 SGK Hóa học 10
Cho phản ứng : Zn + CuCl2 → ZnCl2 + Cu
Trong phản ứng này, 1 mol ion Cu2+:
A. đã nhận 1 mol electron.
B. đã nhận 2 mol electron,
C. đã nhường 1 mol electron.
D. đã nhường 2 mol electron.
Chọn đáp án đúng.
Phương pháp giải
Cu2+ + 2e → Cu
Dựa vào phản ứng để xác định số e nhận
Hướng dẫn giải
Cu2+ + 2e → Cu
→ 1 mol Cu2+ đã nhận 2 mol electron
Đáp án B
3. Giải bài 3 trang 86 SGK Hóa học 10
Cho các phản ứng sau :
A. Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
B. 2Na + 2H2O → 2NaOH + H2
C. NaH + H2O → NaOH + H2
D. 2F2 + 2H2O → 4HF + O2
Phản ứng nào không phải là phản ứng oxi hoá - khử ?
Phương pháp giải
Phản ứng mà các chất không có sự thay đổi số oxi hóa → không phải là phản ứng oxi hóa khử.
Hướng dẫn giải
Vì không có sự thay đổi số oxi hóa của các nguyên tố trước và sau phản ứng
Đáp án A
4. Giải bài 4 trang 86 SGK Hóa học 10
Dấu hiệu để nhận biết một phản ứng oxi hoá - khử :
A. Tạo ra chất kết tủa.
B. Tạo ra chất khí.
C. Có sự thay đổi màu sắc của các chất.
D. Có sự thay đổi số oxi hoá của một hay một số nguyên tố.
Chọn đáp án đúng.
Phương pháp giải
Xem lại lý thuyết về phản ứng oxi hóa - khử
Hướng dẫn giải
Dấu hiệu để nhận biết một phản ứng oxi hoá - khử là có sự thay đổi số oxi hoá của một hay một số nguyên tố.
⇒ Đáp án D.
5. Giải bài 5 trang 87 SGK Hóa học 10
Trong những phản ứng sau đây, phản ứng nào là phản ứng oxi hoá - khử ? Giải thích.
a) SO3 + H2O → H2SO4
b) СаСОз + 2HCl → CaCl2 + CO2 + H2O
c) С + H2O → CO + H2
d) CO2 + Ca(OH)2 → СаСОз + H2O
e) Ca + 2H2 → Ca(OH)2 + H2
g) 2KMnO4 → K2MnO4 + MnO2 + O2.
Phương pháp giải
Xem lại lý thuyết phản ứng oxi hóa - khử
Hướng dẫn giải
Trong những phản ứng trên chỉ có phản ứng c), e), g) là những phản ứng oxi hoá - khử vì có sự thay đối số oxi hoá của các nguyên tố
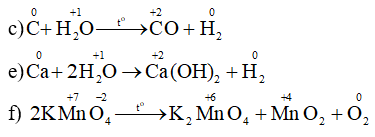
6. Giải bài 6 trang 87 SGK Hóa học 10
Lấy ba thí dụ phản ứng hoá hợp thuộc loại phản ứng oxi hoá - khử và ba thí dụ phản ứng hoá hợp không là loại phản ứng oxi hoá - khử.
Phương pháp giải
- Phản ứng hoá hợp thuộc loại phản ứng oxi hoá - khử
- Phản ứng hoá hợp không thuộc loại phản ứng oxi hoá - khử
Hướng dẫn giải
Ba thí dụ phản ứng hoá hợp thuộc loại phản ứng oxi hoá - khử:
\(\begin{array}{l}
3\mathop {Fe}\limits^0 + 2{O_2} \to \mathop {F{e_3}}\limits^{ - \frac{8}{3}} {O_4}\\
\mathop {{H_2}}\limits^0 + \mathop {C{l_2}}\limits^{ + 1} \to 2\mathop H\limits^{ + 1} \mathop {Cl}\limits^{ - 1} \\
2\mathop {{H_2}}\limits^0 + \mathop {{O_2}}\limits^0 \to 2\mathop {{H_2}}\limits^{ + 1} \mathop O\limits^{ - 2}
\end{array}\)
Ba thí dụ phản ứng hoá hợp không thuộc loại phản ứng oxi hoá - khử :
CaO + CO2 → CaCO3
Na2O + H2O → 2NaOH
SO3 + H2O → H2SO4.
7. Giải bài 7 trang 87 SGK Hóa học 10
Lấy 3 thí dụ phản ứng phân hủy là loại phản ứng oxi hoá - khử và ba thí dụ phản ứng phân hủy không là loại phản ứng oxi hoá - khử.
Phương pháp giải
- Phản ứng phân hủy là phản ứng hóa học trong đó một chất sinh ra hai hay nhiều chất mới
- Phản ứng oxi hóa - khử là phản ứng hoá học trong đó có sự chuyển electron giữa các chất phản ứng.
- Dấu hiệu nhận biết: Phản ứng có sự thay đổi số oxi hóa của một số nguyên tố.
Hướng dẫn giải
Ba thí dụ phản ứng phân hủy là phản ứng oxi hoá - khử :
\(\begin{gathered}
KCl{O_3}\xrightarrow{{{t^0}}}KCl + \frac{3}{2}{O_2} \hfill \\
2KMn{O_4}\xrightarrow{{{t^0}}}{K_2}Mn{O_4} + Mn{O_2} + {O_2} \hfill \\
AgN{O_3}\xrightarrow{{{t^0}}}Ag + N{O_2} + \frac{1}{2}{O_2} \hfill \\
\end{gathered} \)
Ba thí dụ phản ứng phân hủy không là phản ứng oxi hoá - khử
Cu(OH)2  CuO + H2O
CuO + H2O
СаСОз  CaO + CO2
CaO + CO2
\(2NaHC{O_3}\xrightarrow{{{t^0}}}N{a_2}C{O_3} + C{O_2} + {H_2}O\)
8. Giải bài 8 trang 87 SGK Hóa học 10
Vì sao phản ứng thế luôn luôn là loại phản ứng oxi hoá - khử ?
Phương pháp giải
Xem lại lý thuyết phản ứng oxi hóa - khử
Hướng dẫn giải
Sở dĩ phản ứng thế luôn luôn là loại phản ứng oxi hoá - khử vì trong phản ứng thế, bao giờ cũng có sự thay đổi số oxi hoá của các nguyên tố.
9. Giải bài 9 trang 87 SGK Hóa học 10
Viết phương trình hoá học của các phản ứng biểu diễn các chuyển đổi sau :
\(\begin{gathered}
a)KCl{O_3}\xrightarrow{{(1)}}{O_2}\xrightarrow{{(2)}}S{O_2}\xrightarrow{{(3)}}N{a_2}S{O_3} \hfill \\
b)S\xrightarrow{{(1)}}{H_2}S\xrightarrow{{(2)}}S{O_2}\xrightarrow{{(3)}}S{O_3}\xrightarrow{{(4)}}{H_2}S{O_4} \hfill \\
\end{gathered} \)
Trong các phản ứng trên, phản ứng nào là phản ứng oxi hoá - khử ?
Phương pháp giải
- Xem lại lý thuyết phản ứng oxi hóa - khử
- Viết PTHH, xác định số oxi hóa khử
- Phân loại phản ứng
Hướng dẫn giải
a)
(1) 2КСlO3 → 2KCl + 3O2 ;
(2) S + O2 → SO2
(3) SO2 + 2NaOH → Na2SO3 + H2O
Phản ứng oxi hoá - khử là (1) và (2).
b)
(1) S + H2 → H2S ;
(2) 2H2S + 3O2 → 2SO2 + 2H2O
(3) 2SO2 + O2 → 2SO3
(4) SO3 + H2O → H2SO4
Phản ứng oxi hoá - khử là : (1); (2); (3)
