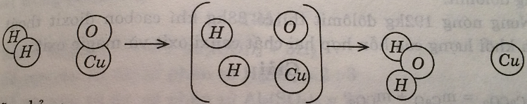Giải bài tập SBT Hóa 8 Bài 17: Luyện tập chương 2
Hướng dẫn Giải bài tập Sách bài tập Hóa học 8 Bài 17 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về phản ứng hóa học. Mời các em cùng theo dõi.
Mục lục nội dung
1. Giải bài 17.1 trang 23 SBT Hóa học 8
2. Giải bài 17.2 trang 23 SBT Hóa học 8
3. Giải bài 17.3 trang 23 SBT Hóa học 8
4. Giải bài 17.4 trang 23 SBT Hóa học 8
5. Giải bài 17.5 trang 23 SBT Hóa học 8
6. Giải bài 17.6 trang 24 SBT Hóa học 8
7. Giải bài 17.7 trang 24 SBT Hóa học 8
8. Giải bài 17.8 trang 24 SBT Hóa học 8
9. Giải bài 17.9 trang 24 SBT Hóa học 8
10. Giải bài 17.10 trang 24 SBT Hóa học 8
11. Giải bài 17.11 trang 24 SBT Hóa học 8

1. Giải bài 17.1 trang 23 SBT Hóa học 8
Hình dưới đây là sơ đồ tượng trưng cho phản ứng giữa khí hidro H2 và chất đồng (II) oxit CuO tạo ra kim loại đồng và nước:
Hãy chỉ ra:
a) Mỗi phản ứng xảy ra với bao nhiêu phân tử của mỗi chất phản ứng, tạo ra bao nhiêu phân tử nước và nguyên tử đồng?
b) Liên kết giữa những nguyên tử trong phân tử nào bị tách rời, trong phân tử nào được tạo ra?
Phương pháp giải
Để trả lời các câu hỏi trên cần nắm rõ tính chất về phản ứng hóa học.
Hướng dẫn giải
a) Mỗi phản ứng xảy ra với một phân tử H2 và một phân tử CuO, tạo ra một phân tử nước và một nguyên tử đồng.
b) Liên kết giữa những nguyên tử trong phân tử H2 và trong phân tử CuO bị tách rời.
Liên kết giữa những nguyên tử trong phân tử nước mới được tạo ra.
2. Giải bài 17.2 trang 23 SBT Hóa học 8
Trong một phản ứng hóa học, chất phản ứng và sản phẩm phải chứa cùng:
A. Số nguyên tử trong mỗi chất
B. Số nguyên tố tạo ra chất
C. Số nguyên tử của mỗi nguyên tố
D. Số phân tử của mỗi chất
Khẳng định nào là đúng (A,B, C hay D)?
Phương pháp giải
Trong phản ứng hóa học, chỉ có liên kết giữa các nguyên tử thay đổi làm cho phân tử này biến đổi thành phân tử khác => Số nguyên tử trước và sau phản ứng không thay đổi.
Hướng dẫn giải
Trong một phản ứng hóa học, chất phản ứng và sản phẩm phải chứa cùng số nguyên tử của mỗi nguyên tố.
Đáp án C.
3. Giải bài 17.3 trang 23 SBT Hóa học 8
Dây tóc trong bóng đèn nóng đỏ và phát sáng mỗi khi có dòng điện đi qua. Trường hợp bóng đèn bị nứt và không khí (có khí oxi) chui vào bên trong thì dây tóc bị cháy khi bật công tắc điện. (Xem lại bài tập 2.2 về dây tóc trong dây điện).
Hãy phân tích và chỉ ra khi nào xảy ra hiện tượng vật lí, khi nào xảy ra hiện tượng hóa học.
Phương pháp giải
Để trả lời các câu hỏi trên cần nắm rõ tính chất về hiện tượng hóa học.
Hướng dẫn giải
- Mỗi khi có dòng điện đi qua, kim loại vonfram (dây tóc bóng đèn điện) nóng đỏ và phát sáng, sau khi ngắt điện (không có dòng điện) kim loại vonfram lại trở về như cũ. Do tác dụng của dòng điện làm cho kim loại vonfram nóng đỏ và phát sáng, đó là hiện tượng vật lí.
- Kim loại vonfram bị cháy khi có dòng điện đi qua (bật công tắc điện) là do kim loại nóng lên lại có khí oxi (trong không khí chui vào) nên phản ứng với chất này (tương tự kim loại magie, xem bài tập 3, thuộc bài 15, SGK) và biến đổi thành chất khác, đó là hiện tượng hoá học.
4. Giải bài 17.4 trang 23 SBT Hóa học 8
Đá đôlomit là hỗn hợp hai chất canxi cacbonat CaCO3 và magie cacbonat MgCO3. Khi nung nóng, tương tự canxi cacbonat, từ chất magie cacbonat cũng tạo ra chất magie oxit MgO và khí cacbon đioxit.
a) Viết công thức về khối lượng của hai phản ứng xảy ra khi nung nóng đôlômit.
b) Nung nóng 192kg đôlômit thì có 88kg khí cacbon đioxit thoát ra. Tính khối lượng của hỗn hợp hai chất canxi oxit và magie oxit.
Phương pháp giải
a) Áp dụng định luật bảo toàn khối lượng.
\({m_{CaC{O_3}}} = {m_{CaO}} + m_{C{O_2}}^\prime \)
\({m_{MgC{O_3}}} = {m_{MgO}} + {m"}_{C{O_2}}\prime \)
b) Trong một phản ứng có n chất, nếu biết khối lượng của (n – 1) chất thì tính được khối lượng của chất còn lại.
Hướng dẫn giải
a) Áp dụng định luật bảo toàn khối lượng:
\({m_{CaC{O_3}}} = {m_{CaO}} + m_{C{O_2}}^\prime \)
\({m_{MgC{O_3}}} = {m_{MgO}} + {m"}_{C{O_2}}\prime \)
b) Khối lượng của hỗn hợp 2 chất canxit oxit và magie oxit:
mhh = mđôlômit – mCO2 = 192 – 88 = 104 kg
5. Giải bài 17.5 trang 23 SBT Hóa học 8
Cho sơ đồ của các phản ứng sau:
a) K + O2 → K2O
b) Al + CuCl2 → AlCl3 + Cu
c) NaOH + Fe2(SO4)3 → Fe(OH)3 + Na2SO4
Lập phương trình hóa học của mỗi phản ứng và cho biết tỉ lệ só nguyên tử, số phân tử của hai cặp chất trong phản ứng ( tùy chọn).
Phương pháp giải
- Bước 1. Cần viết đúng các công thức hoá học. Đến bước sau không thay đổi chỉ số trong những công thức đã viết đúng.
- Bước 2. Nhẩm tính số nguyên tử của tất cả các nguyên tố
Nếu có nguyên tố mà số nguyên tử một bên lẻ, một bên chẵn thì trước hết ta làm chẵn số nguyên tử lẻ (đặt hệ số 2).
Để cân bằng số nguyên tử ta lấy bội số chung nhỏ nhất chia cho các số nguyên tử không bằng nhau của một nguyên tố thì được hệ số cho công thức của các chất tương ứng. Nên bắt đầu từ nguyên tố mà số nguyên tử có nhiều nhất, rồi tiếp đến nguyên tố có số nguyên tử ít hơn...
Hướng dẫn giải
a) 4K + O2 → 2K2O
Số nguyên tử K : số phân tử O2 = 4 : 1
Số nguyên tử K : số phân tử K2O = 4 : 2 = 2 : 1
b) 2Al + 3CuCl2 → 2AlCl3 + 3Cu
Cứ 2 nguyên tử Al tác dụng với 3 phân tử CuCl2.
Cứ 2 nguyên tử Al phản ứng tạo ra 3 nguyên tử Cu.
c) 6NaOH + Fe2(SO4)3 → 2Fe(OH)3 + 3Na2SO4
Cứ 6 phân tử NaOH tác dụng với 1 phân tử Fe2(SO4)3 ;
Cứ 6 phân tử NaOH phản ứng tạo ra 2 phân tử Fe(OH)3 ;
hay cứ 3 phân tử NaOH phản ứng tạo ra 1 phân tử Fe(OH)3.
6. Giải bài 17.6 trang 24 SBT Hóa học 8
Biết rằng khí axetilen (khí đất đèn) C2H2 cháy là xảy ra phản ứng với khí oxi O2, sinh ra khí cacbon đioxit CO2 và nước.
a) Lập phương trình hóa học của phản ứng.
b) Cho biết tỉ lệ giữa số phân tử axetilen lần lượt với số phân tử khí cacbon đioxit và số phân tử nước.
Phương pháp giải
- Bước 1. Cần viết đúng các công thức hoá học. Đến bước sau không thay đổi chỉ số trong những công thức đã viết đúng.
- Bước 2. Nhẩm tính số nguyên tử của tất cả các nguyên tố
Nếu có nguyên tố mà số nguyên tử một bên lẻ, một bên chẵn thì trước hết ta làm chẵn số nguyên tử lẻ (đặt hệ số 2).
Để cân bằng số nguyên tử ta lấy bội số chung nhỏ nhất chia cho các số nguyên tử không bằng nhau của một nguyên tố thì được hệ số cho công thức của các chất tương ứng. Nên bắt đầu từ nguyên tố mà số nguyên tử có nhiều nhất, rồi tiếp đến nguyên tố có số nguyên tử ít hơn...
Hướng dẫn giải
a) 2C2H2 + 5O2 → 4CO2 + 2H2O
b) Số phân tử C2H2 : số phân tử CO2 = 1 : 2
Số phân tử C2H2 : số phân tử H2O = 1 : 1
7. Giải bài 17.7 trang 24 SBT Hóa học 8
Biết rằng kim loại nhôm tác dụng với axit sunfuric H2SO4 tạo ra khi hidro H2 và chất nhôm sunfat Al2(SO4)3
a) Lập phương trình hóa học của phản ứng.
b) Cho biết tỉ lệ giữa số nguyên tử Al lần lượt với số phân tử của ba chất trong phản ứng.
Phương pháp giải
- Bước 1. Cần viết đúng các công thức hoá học. Đến bước sau không thay đổi chỉ số trong những công thức đã viết đúng.
- Bước 2. Nhẩm tính số nguyên tử của tất cả các nguyên tố
Nếu có nguyên tố mà số nguyên tử một bên lẻ, một bên chẵn thì trước hết ta làm chẵn số nguyên tử lẻ (đặt hệ số 2).
Để cân bằng số nguyên tử ta lấy bội số chung nhỏ nhất chia cho các số nguyên tử không bằng nhau của một nguyên tố thì được hệ số cho công thức của các chất tương ứng. Nên bắt đầu từ nguyên tố mà số nguyên tử có nhiều nhất, rồi tiếp đến nguyên tố có số nguyên tử ít hơn...
Hướng dẫn giải
a) 2Al + 3H2SO4 -> Al2(SO4)3 + 3H2↑
b) Cứ 2 nguyên tử Al tác dụng với 3 phân tử H2SO4 ;
Cứ 2 nguyên tử Al phản ứng tạo ra 1 phân tử Al2(SO4)3 ;
Cứ 2 nguyên tử Al phản ứng tạo ra 3 phân tử H2.
8. Giải bài 17.8 trang 24 SBT Hóa học 8
Hãy chọn hệ số và công thức hóa học thích hợp điền vào những chỗ có dấu hỏi trong các phương trình hóa học sau (chép vào vở bài tập).
a) CO2 + Ca(OH)2 → CaCO3 + ?
b) ? + ?AgNO3 → Al(NO3)3 + 3Ag
c) ?HCl + CaCO3 → CaCl2 + H2O + ?
Phương pháp giải
Cách cân bằng nhanh phương trình hóa học:
- Bước 1. Cần viết đúng các công thức hoá học. Đến bước sau không thay đổi chỉ số trong những công thức đã viết đúng.
- Bước 2. Nhẩm tính số nguyên tử của tất cả các nguyên tố
Nếu có nguyên tố mà số nguyên tử một bên lẻ, một bên chẵn thì trước hết ta làm chẵn số nguyên tử lẻ (đặt hệ số 2).
Để cân bằng số nguyên tử ta lấy bội số chung nhỏ nhất chia cho các số nguyên tử không bằng nhau của một nguyên tố thì được hệ số cho công thức của các chất tương ứng. Nên bắt đầu từ nguyên tố mà số nguyên tử có nhiều nhất, rồi tiếp đến nguyên tố có số nguyên tử ít hơn...
Hướng dẫn giải
a) CO2 + Ca(OH)2 → CaCO3 + H2O
b) Al + 3AgNO3 → Al(NO3)3 + 3Ag
c) 2HCl + CaCO3 → CaCl2 + H2O + CO2↑
9. Giải bài 17.9 trang 24 SBT Hóa học 8
Cho sơ đồ phản ứng sau: Fe(OH)y + H2SO4 → Fex(SO4)y + H2O
a) Hãy biện luận để thay x, y (biết rằng x ≠ y) bằng các chỉ số thích hợp rồi lập phương trình hóa học của phản ứng.
b) Cho biết tỉ lệ só phân tử của bốn cặp chất trong phản ứng (tùy chọn).
Phương pháp giải
- Fe có hoá trị II và III nên y bằng 2 hoặc 3
Mặt khác, nhóm (SO4) có hoá trị II => x, y
- Lập phương trình hóa học của phản ứng theo ba bước:
+ Viết sơ đồ phản ứng, gồm công thức hóa học của các chất tham gia sản phẩm.
+ Cân bằng số nguyên tử mỗi nguyên tố: tìm hệ số thích hợp đặt trước công thức.
+ Viết thành phương trình hóa học.
Hướng dẫn giải
a) Nguyên tố Fe có hoá trị II và III nên y bằng 2 hoặc 3
Nhóm (SO4) có hoá trị II nên x bằng 2
Cặp nghiệm x= 2 và y = 3 là phù hợp.
Sơ đồ của phản ứng :
Fe(OH)3 + H2SO4 —> Fe2(SO4)3 + H2O
Phương trình hoá học :
2Fe(OH)3 + 3H2SO4 -> Fe2(SO4)3 + 6H2O
b) Cứ 2 phân tử Fe(OH)3 tác dụng với 3 phân tử H2SO4 ;
Cứ 2 phân tử Fe(OH)3 phản ứng tạo ra 1 phân tử Fe2(SO4)3 ;
Cứ 3 phân tử H2SO4 phản ứng tạo ra 1 phân tử Fe2(SO4)3 ;
Cứ 1 phân tử Fe2(SO4)3 được tạo ra cùng với 6 phân tử H2O.
10. Giải bài 17.10 trang 24 SBT Hóa học 8
a) Biết rằng khí hidro dễ tác dụng vơi chất chì (IV) oxit PbO2, chiếm lấy oxi của chất này để tạo ra nước.
Viết phương trình hóa học của phản ứng và tên chất mới sinh ra.
b) Biết rằng 3g khí hidro tác dụng vừa đủ với 179,25g PbO2, tạo ra 27g nước. Tính khối lượng chất mới sinh ra.
Phương pháp giải
a) + PbO2 → Pb + 2H2O
b) Áp dụng định luật bảo toàn khối lượng:
= mH2 + mPbO2 − mH2O
Hướng dẫn giải
a) Phương trình hóa học của phản ứng:
2H2 + PbO2 → Pb + 2H2O
Chất sinh ra là kim loại Pb
b) Theo định luật bảo toàn khối lượng, ta có:
mPb =(mPbO2 + mH2) – mH2O = (179,25 + 3) – 27 = 155,25 (g)
11. Giải bài 17.11 trang 24 SBT Hóa học 8
Quặng malachit có thành phần chính là hai hợp chất của đồng được ghi bằng công thức chung là Cu2(OH)2CO3 . Khi nung nóng thì hợp chất này bị phân hủy, sản phẩm của phản ứng phân hủy gồm có CuO, H2O và CO2.
a) Viết phương trình hóa học của phản ứng phân hủy của mỗi hợp chất của đồng.
b) Biết rằng khi nung nóng 4,8kg quặng thì thu được 3,2kg CuO cùng 0,36kg H2O và 0,88kg CO2. Tính tỉ lệ phần trăm về khối lượng hai hợp chất của đồng có chứa trong quặng.
Phương pháp giải
a) Các phương trình hóa học của phản ứng phân hủy:
(OH)2 → CuO + H2O
CO3 → CuO + CO2
b) Áp dụng định luật bảo toàn khối lượng:
2(OH)2CO3 = mCuO + mH2O + mCO2
=> (OH)2CO3 = mCu2(OH)2CO3/mquặng.100%
Hướng dẫn giải
a) Công thức hóa học của hai hợp chất của đồng:
Cu2(OH)2CO3 → Cu(OH)2 và CuCO3
Các phương trình hóa học của phản ứng phân hủy:
Cu(OH)2 → CuO + H2O
CuCO3 → CuO + CO2
b) Theo định luật bảo toàn khối lượng, khối lượng hai hợp chất của đồng phân hủy bằng:
mCu2(OH)2CO3 = mCuO + mH2O + mCO2 = 3,2 + 0,36 + 0,88 = 4,44 (g).
Tỉ lệ phần trăm về khối lượng hai hợp chất của đồng có chứa trong quặng:
mCu2(OH)2CO3 = (4,44 . 100)/ 4,8 = 92,5%
12. Giải bài 17.12 trang 25 SBT Hóa học 8
Để điều chế kali clorua KCl (dùng làm phân bón), người ta cho kim loại kali K tác dụng với khí clo Cl2.
a) Viết phương trình hóa học của phản ứng.
b) Nếu có 6,02.1023 nguyên tử K, cần lấy vào phản ứng bao nhiêu phân tử Cl2 và thu được bao nhiêu phân tử KCl?
(Xem lại các bài tập 8.9*,9.6*,16.8* trước khi làm bài tập này và bài tập tiếp theo).
Phương pháp giải
a) Phương trình hóa học của phản ứng :
+ Cl2 → 2KCl
b) Xem lại bài 16.8*
Hướng dẫn giải
a) Phương trình hóa học: 2K + Cl2 → 2KCl
b) Theo phương trình hóa học, ta có tỉ lệ:
Cứ 2 nguyên tử K tác dụng với 1 phân tử Cl2 tạo thành 2 phân tử KCl.
Vậy số Clo lấy vào phản ứng khi có 6,02.1023 phân tử K:
Số phân tử Cl2 = (6,02.1023 : 2) = 3,01.1023 (phân tử)
Số phân tử KCl được tạo ra: (2.6,02.1023 : 2) = 6,02.1023 (phân tử).
13. Giải bài 17.13 trang 25 SBT Hóa học 8
Những câu trong bài tập này coi là tiếp theo của bài tập 17.12*.
a) Tính khối lượng bằng gam của:
- 6,02.1023 nguyên tử K,
- 6,02.1023 nguyên tử Cl2,
- 6,02.1023 phân tử KCl
b) Tính khối lượng khí clo để tác dụng vừa đủ với 39g kim loại kali.
c) Từ khối lượng kim loại cho biết và khối lượng khí clo tính được trong câu b), tính khối lượng kali clorua thu được theo hai cách.
Phương pháp giải
a), b) Xem lại câu 8.9*
c) Cách 1: Tính theo phương trình hóa học.
Cách 2: Áp dụng định luật bảo toàn khối lượng.
Hướng dẫn giải
a) Khối lượng tính bằng gam của:
- 6,02.1023 nguyên tử K: 6,02.1023 x 39.1,66.10-24 ≈ 39 (g).
- 6,02.1023 nguyên tử Cl2: 6,02.1023 x 71.1,66.10-24 ≈ 71 (g).
- 6,02.1023 phân tử KCl: 6,02.1023 x 74,5.1,66.10-24 ≈ 74,5 (g).
b) 39 g kim loại kali là khối lượng của 6,02.1023 nguyên tử K.
Số lượng nguyên tử K này tác dụng đủ với 3,01.1023 phân tử Cl2.
Khối lượng của số phân tử khí Cl2 này là = 35,5 (g).
c) Cách 1 : Theo phương trình hoá học trong bài 17.12* thì 6,02.1023 nguyên tử K tác dụng với 3,01.1023 phân tử Cl2 tạo ra 6,02.1023 phân tử KCl. Vậy khối lượng KCl thu được là 74,5 g.
Cách 2 : Theo định luật bảo toàn khối lượng :
= mK + mCl2 = 39 + 35,5 = 74,5 (g).