Giải bài tập SBT Hóa 8 Bài 27: Điều chế oxi- Phản ứng phân hủy
Hướng dẫn Giải bài tập Sách bài tập Hóa học 8 Bài 27 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về điều chế oxi và phản ứng phân hủy. Mời các em cùng theo dõi.
Mục lục nội dung
1. Giải bài 27.1 trang 32 SBT Hóa học 8
2. Giải bài 27.2 trang 37 SBT Hóa học 8
3. Giải bài 27.3 trang 37 SBT Hóa học 8
4. Giải bài 27.4 trang 38 SBT Hóa học 8
5. Giải bài 27.5 trang 38 SBT Hóa học 8
6. Giải bài 27.6 trang 38 SBT Hóa học 8
7. Giải bài 27.7 trang 38 SBT Hóa học 8

1. Giải bài 27.1 trang 37 SBT Hóa học 8
Cho các phản ứng sau:
(1) 2NaNO3 \(\xrightarrow{{{t^o}}}\) 2NaNO2 + O2↑
(2) 2H2O \(\xrightarrow{{dien\,phan}}\) 2H2 + O2↑
(3) CaO + CO2 → CaCO3
(4) ZnS + 3O2 \(\xrightarrow{{{t^o}}}\) 2ZnO + 2SO2↑
(5) K2O + H2O → 2KOH
(6) 2HNO3 \(\xrightarrow{{{t^o}}}\) 2NO2 + H2O + 12O2↑
Số phản ứng thuộc loại phản ứng phân hủy là
A. 2
B. 3
C. 4
D. 5
Phương pháp giải
Cần nắm rõ lý thuyết về phản ứng phân hủy để chọn đáp án đúng.
Hướng dẫn giải
Các phản ứng phân hủy là: (1); (2); (6)
=> Chọn B.
2. Giải bài 27.2 trang 37 SBT Hóa học 8
Trong bài thực hành thu khí oxi vào ống nghiệm bằng cách đẩy nước và đẩy không khí. Có 4 học sinh A, B, C, D đã lắp ráp dụng cụ thí nghiệm như sau đây. Hãy cho biết học sinh nào lắp ráp đúng? Giải thích. Xác định công thức các chất 1,2,3 có trong hình vẽ của thí nghiệm.
Phương pháp giải
Để giải thích thí nghiệm trên ta dựa vào phương pháp thu khí oxi: phương pháp đẩy nước.
Hướng dẫn giải
Chất 1 có thể là : KMnO4, KClO3, KNO3 …, chất 2 : khí oxi; chất 3 : nước.
Học sinh A lắp ráp đúng ; học sinh B lắp ráp không đúng vì ống dẫn khí không đi vào ống nghiệm đựng nước do đó oxi bị mất một phần.
Học sinh C đã lắp ráp đúng ; học sinh D đã lắp ráp không đúng vì ống dẫn khí oxi không đi vào ống nghiệm, dẫn đến sự mất mát khí oxi.
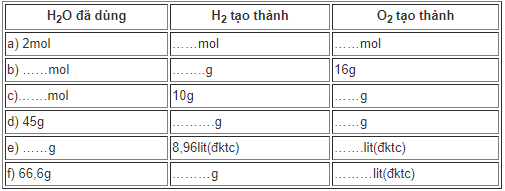
3. Giải bài 27.3 trang 38 SBT Hóa học 8
Điều chế oxi trong công nghiệp bằng phương pháp điện phân nước ( có axit sunfuric), thu được 2 chất khí riêng biệt là oxi và hidro. Phương trình điện phân nước được biểu diễn như sau:
O \(\xrightarrow{{dien\,phan}}\) 2H2 + O2
Điền những số liệu thích hợp vào chỗ trống trong bảng dưới đây:
(Giả sử phản ứng điện phân nước xảy ra hoàn toàn).
Phương pháp giải
- Phương trình hóa học: O \(\xrightarrow{{dien\,phan}}\) 2H2 + O2
- Áp dụng các công thức: m=n.M; V=22,4.n để điền số liệu thích hợp vào ô trống.
Hướng dẫn giải
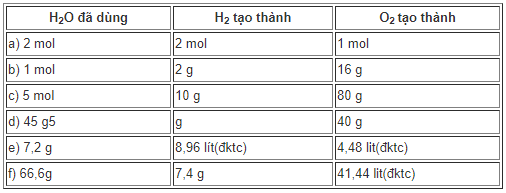
a) Theo tỉ lệ phương trình: nH2O = 2 mol ⇒ nH2 = 2 mol; nO2 = 1.2/2 = 1 mol
b) nO2 = 16/32 = 0,5 mol ⇒ nH2O = nH2 = 2.nO2 = 2. 0,5 = 1 mol; mH2 = 1.2 = 2g
c) nH2 = 10/2 = 5 mol ⇒ nH2O = nH2 = 5mol ; nO2 = 5.1/2 = 2,5 mol ⇒ mO2 = 32. 2,5 = 80g
d) nH2O = 45/18 = 2,5 mol ⇒ nH2 = 2,5 mol ⇒ mH2 = 2,5. 2 = 5g
nO2 = 2,5.1/2 = 1,25 mol ⇒mO2 = 32. 1,25 = 40g
e) nH2 = 8,96/22,4 = 0,4 mol ⇒ nH2O = 0,4 mol ⇒ mH2O = 0,4 .18 = 7,2 g
nO2 = 0,4.1/2 = 0,2 mol ⇒ VO2 = 0,2 . 22,4 = 4,48 l
f) nH2O = 66,6/18 = 3,7 mol ⇒ nH2 = 3,7 mol ⇒ mH2 = 3,7 .2 = 7,4 g
nO2 = 3,7.1/2 = 1,85 mol ⇒ VO2 = 41,44 lit
4. Giải bài 27.4 trang 38 SBT Hóa học 8
a) Trong những chất sau, những chất nào được dùng để điều chế khí oxi? Viết phương trình phản ứng và nêu điều kiện phản ứng: CuSO4; KClO3; CaCO3; KMnO4; H2O; K2SO4; HgO
b) Tất cả các phản ứng điều chế O2 có thể gọi là phản ứng phân hủy không? Hãy giải thích.
Phương pháp giải
Cần nắm rõ lý thuyết về phản ứng phân hủy để viết phương trình hóa học.
Hướng dẫn giải
a) Các chất được dùng để điều chế oxi: KClO3; KMnO4; H2O; HgO.
2KClO3 → 2KCl + 3O2
2KMnO4 → K2MnO4 + MnO2 + O2
2H2O → 2H2 + O2
2HgO → 2Hg + O2
b) Tất cả phản ứng điều chế O2 đều là phản ứng phân hủy vì từ 1 chất sau phản ứng tạo ra nhiều chất mới.
5. Giải bài 27.5 trang 38 SBT Hóa học 8
Để điều chế một lượng lớn oxi trong công nghiệp người ta dùng những phương pháp nào và bằng những nguyên liệu gì?
Phương pháp giải
Cần nắm rõ lý thuyết về cách điều chế oxi để trả lời câu hỏi trên.
Hướng dẫn giải
Để điều chế một lượng lớn oxi trong công nghiệp người ta thường dùng phương pháp điện phân nước hoặc hoá lỏng không khí (ở -196 °C) rồi cho bay hơi trở lại, nitơ thoát ra trước rồi đến oxi. Nguồn nguyên liệu phong phú và rẻ tiền là nước và không khí.
6. Giải bài 27.6 trang 38 SBT Hóa học 8
Lấy cùng một lượng KClO3 và KMnO4 để điều chế oxi. Chất nào tạo ra nhiều khí O2 hơn.
a) Viết phương trình phản ứng và giải thích.
b) Nếu điều chế dùng một thể tích khí oxi thì dùng chất nào kinh tế hơn? Biết rằng giá KMnO4 là 30.000 đ/kg và KClO3 là 96.000 đ/kg.
Phương pháp giải
a) ClO3 \(\xrightarrow{{{t^o}}}\) 2KCl + 3O2↑
MnO4 \(\xrightarrow{{{t^o}}}\) K2MnO4 + O2↑ + MnO2
Giả sử ta lấy cùng một khối lượng là a gam
Từ phương trình phản ứng, tính lượng oxi thu được với từng chất
So sánh số mol oxi tạo thành => rút ra kết luận.
b) Để điều chế cùng một thể tích khí oxi ta tính lượng KClO3 và KMnO4 cần dùng tương ứng.
Từ đó tính giá tiền cần dùng để biết chất nào kinh tế hơn
Hướng dẫn giải
a) MKClO3 = 122,5(g/mol); MKMnO4 = 158(g/mol)
Giả sử ta lấy cùng một khối lượng là a gam
2KClO3 ⟶ 2KCl +3O2↑
2 mol 3 mol
a/122,5 3a/2.122,5
2KMnO4 ⟶ K2MnO4 + O2↑ + MnO2
2 mol 1 mol
a/158 a/2.158
3a/2.122,5 > a/2.158
Khi nhiệt phân cùng 1 lượng, chất cho nhiều O2 hơn là KClO3
b) Nếu điều chế cùng một thể tích khí O2 thì dùng KClO3 để điều chế kinh tế hơn, tuy giá tiền 1 kg cao hơn nhưng thể tích khí O2 sinh ra nhiều hơn. Tính toán cụ thể như sau :
ClO3 \(\xrightarrow{{{t^o}}}\) 2KCl + 3O2↑
2 mol 3 mol
1 mol 1,5 mol
=1.122,5=122,5(g)
Số tiền mua 122,5 g để điều chế 1,5 mol là
0,1225 . 96000 = 11760(đ)
MnO4 \(\xrightarrow{{{t^o}}}\) K2MnO4 + O2↑ + MnO2
2 mol 1 mol
3 mol 1,5 mol
= 3.158 = 474(g)
Số tiền mua 474 g nO4 để điều chế 1,5 mol à:
0,474 . 30000 = 14220(đ)
Vậy để điều chế cùng 1 thể tích khí O2 thì dùng KClO3 để điều chế kinh tế hơn mặc dù giá tiền cao mua 1 kg KClO3 cao hơn nhưng thể tích khí O2 sinh ra nhiều hơn.
7. Giải bài 27.7 trang 38 SBT Hóa học 8
Dùng 3,2 kg khí oxi để đốt cháy khí axetilen. Hỏi với lượng khí oxi như trên, có thể đốt cháy bao nhiêu m3 khí axetilen ( đktc).
Phương pháp giải
- Tính số mol oxi
- PTHH: 2C2H2 + 5O2 → 4CO2 + 2H2O
- Tính theo phương trình hóa học => số mol khí axetilen
Hướng dẫn giải
Số mol khí oxi: \(\frac{{3,2.1000}}{{32}} = 100mol\)
Phương trình hóa học:
2C2H2 + 5O2 → 4CO2 + 2H2O
2 mol 5 mol
x mol 100mol
x = 100.25 = 40 (mol)
Số m3 khí axetilen bị đốt cháy: \(\frac{{44.22,4}}{{1000}} = 0,896{m^3}\)
8. Giải bài 27.8 trang 38 SBT Hóa học 8
Đốt cháy hoàn toàn 5,4g Al.
a) Tính thể tích oxi cần dùng.
b) Tính số gam KMnO4 cần dùng để điều chế lượng oxi trên.
Phương pháp giải
a) Tính số mol Al
PTHH: 4Al + 3O2 \(\xrightarrow{{{t^o}}}\) 2Al2O3
Tính theo PTHH=> số mol oxi => thể tích oxi
b) PTHH: 2KMnO4 ⟶ K2MnO4 + O2↑ + MnO2
Dựa theo PTHH tính số mol KMnO4=> khối lượng KMnO4
Hướng dẫn giải
a) Số mol Al = 5,4 : 27 = 0,2 mol
4Al + 3O2 \(\xrightarrow{{{t^o}}}\) 2Al2O3
4 mol 3 mol
0,2 mol x mol
\(x = \frac{{0,2.3}}{4} = 0,15mol\)
Thể tích khí oxi cần dùng để đốt chấy hoàn toàn 5,4 g Al là: 0,15.22,4 = 3,36 (lít)
b) Phương trình hóa học
2KMnO4 ⟶ K2MnO4 + O2↑ + MnO2
2 mol 1 mol
y mol 0,15 mol
nKMnO4 = y = 0,15.2 = 0,30 (mol)
Khối lượng KMnO4 cần dùng để điều chế 0,15 mol oxi là: 0,30.158 = 47,4(g)
9. Giải bài 27.9 trang 39 SBT Hóa học 8
Người ta điều chế vôi sống (CaO) bằng cách nung đá vôi CaCO3. Lượng vôi sống thu được từ 1 tấn đá vôi có chứa 10% tạp chất là:
A. 0,252 tấn.
B. 0,378 tấn.
C. 0,504 tấn
D. 0,606 tấn.
(Biết hiệu suất phản ứng là 100%).
Phương pháp giải
- Tính khối lượng CO3 trong 1 tấn đá vôi
- Phương trình nhiệt phân
CaCO3 \(\xrightarrow{{{t^o}}}\) CaO + CO2↑
- Tính theo PTHH => lượng vôi sống thu được
Hướng dẫn giải
Khối lượng CaCO3 trong 1 tấn đá vôi là
\(\frac{{1.90}}{{100}} = 0,9\) (tấn)
Phương trình nhiệt phân
CaCO3 \(\xrightarrow{{{t^o}}}\) CaO + CO2↑
100 tấn 56 tấn
0,9 tấn x tấn
Lượng vôi sống thu được là:
\({m_{CaO}} = \frac{{0,9.56}}{{100}} = 0,504\) tấn
Đáp án cần chọn là C.