Giải bài tập SBT Hóa 8 Bài 42: Nồng độ dung dịch
Hướng dẫn Giải bài tập Sách bài tập Hóa học 8 Bài 42 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về nồng độ dung dịch. Mời các em cùng theo dõi.
Mục lục nội dung

1. Giải bài 42.1 trang 57 SBT Hóa học 8
Hãy chọn câu trả lời đúng nhất vào chỉ ra chỗ sai của câu trả lời không đúng sau đây:
a) Nồng độ phần trăm của dung dịch cho biết:
1. Số g chất tan trong 100g dung môi.
2. Số g chất tan trong 100g dung dịch.
3. Số g chất tan trong 1 lít dung dịch.
4. Số g chất tan trong 1 lít dung môi.
5. Số gam chất tan trong một lượng dung dịch xác định.
b) Nồng độ mol của dung dịch cho biết:
1. Số g chất tan trong 1 lít dung dịch.
2. Số mol chất tan trong 1 lít dung dịch.
3. Số mol chất tan trong 1 lít dung môi.
4. Số gam chất tan trong 1 lít dung môi.
5. Số mol chất tan trng một thể tích xác định dung dịch.
Phương pháp giải
Để trả lời các câu hỏi trên cần nắm rõ lý thuyết về dung dịch.
Hướng dẫn giải
a) Câu trả lời đúng là (2).
- Chỗ sai của các câu là :
(1) : Dung môi ;
(3) : 1 lít dung dịch ;
(4) : 1 lít dung môi ;
(5) : Một lượng dung dịch xác định,
b) Câu trả lời đúng là (2).
- Chỗ sai của các câu là :
(1) : Gam ;
(3) : Dung môi ;
(4) : Gam, dung môi ;
(5) : Thể tích xác định.
2. Giải bài 42.2 trang 57 SBT Hóa học 8
Trong phòng thí nghiệm có các lọ đựng dung dịch NaCl, H2SO4, NaOH có cùn nồng độ là 0,5M.
a) Lấy 1 ít mỗi dung dịch trên vào ống nghiệm riêng biệt. Hỏi phải lấy như thế nào để có số mol chất tan có trong mỗi ống nghiệm là bằng nhau?
b) Nếu thể tích dung dịch có trong mỗi ống nghiệm la 5ml. Hãy tính số gam chất tan có trong mỗi ống nghiệm.
Phương pháp giải
a) Áp dụng công thức: CM= n/V
b) Tính số mol chất tan có trong dung dịch. Từ đó tính khối lượng các chất.
Hướng dẫn giải
a) Theo công thức: n = CM.V
Muốn có số mol bằng nhau thì thể tích cũng bằng nhau
Vì CM = 0,5 mol/l. Do đó ta phải lấy thể tích các dung dịch bằng nhau vào các ống nghiệm.
b) Số mol chất tan có trong dung dịch của mỗi ống nghiệm:
V = 5 ml = 0,005 lit
n = CM.V = 0,5.0,005 = 0,0025 (mol)
mNaCl = n.M = 0,0025.58,5 = 0,14625 (g)
mH2SO4 = 0,0025.98 = 0,245 (g)
mNaOH = 0,0025.40 = 0,1 (g)
3. Giải bài 42.3 trang 58 SBT Hóa học 8
Để xác định độ tan của một muối trong nước bằng phương pháp thực nghiệm, người ta dựa vào những kết quả sau:
- Nhiệt độ của dung dịch muối bão hòa đo được là 19oC
- Chén nung rỗng có khối lượng là 47,1g
- Chén nung đựng dung dịch muối bão hà có khối lượng là 69,6g
- Chén nung và muối kết tinh thu được sau khi làm bay hết hơi nước, có khôi lượng là 49,6g
Hãy cho biết:
a) Khối lượng muối kết tinh thu được là bao nhiêu?
b) Độ tan muối ở nhiệt độ 19oC?
c) Nồng độ phần trăm của dung dịch muối bão hòa ở nhiệt độ 19oC?
Phương pháp giải
a) Khối lượng muối kết tinh= khối lượng chén nung đựng dung dịch muối bão hoà - khối lượng chén nung và muối kết tinh thu được sau khi làm bay hết hơi nước.
b) Tính khối lượng nước có trong dung dịch muối bão hòa => Tính độ tan S.
c) Tính khối lượng dung dịch muối => C%.
Hướng dẫn giải
a) Khối lượng của muối tinh khiết: 49,6 - 47,1 = 2,5 (g).
b) mH2O = 69,6 – 49,6 = 20 (g)
Độ tan của muối ở 19oC
\(S = \frac{{{m_{ct}}}}{{{m_{{H_2}O}}}}.100\% = \frac{{2,5}}{{20}}.100 = 12,5(g)\)
c) mdd = 69,6 - 47,1 = 22,5 g
\(C\% = \frac{{{m_{ct}}}}{{{m_{{H_2}O}}}}.100\% = \frac{{2,5}}{{22,5}}.100\% = 11,1\% \)
4. Giải bài 42.4 trang 58 SBT Hóa học 8
Làm bay hơi 300g nước ra khỏi 700g dung dịch muối 12%, nhận thấy 5g muối tách khỏi dung dịch bão hòa. Hãy xác định nồng độ phần trăm của dung dịch muối bão hòa trong điều kiện thí nghiệm trên.
Phương pháp giải
- Bước 1: Tính
- Bước 2: Tính khối lượng muối có trong dung dịch bão hòa.
- Bước 3: Tính
- Bước 4: Áp dụng công thức tính nồng độ C% => nồng độ phần trăm của dung dịch muối bão hoà.
Hướng dẫn giải
Khối lượng muối có trong dung dịch ban đầu:
\({m_{ct}} = \frac{{C\% .{m_{dd}}}}{{100}} = \frac{{12.700}}{{100}} = 84g\)
Khối lượng muối có trong dung dịch bão hòa:
mct = mmuối = 84 -5 = 79(g)
Khối lượng dung dịch muối sau khi bay hơi:
mdd = 700 – (300 + 5) = 395(g)
Nồng độ phần trăm của dung dịch bão hòa:
\(C\% = \frac{{{m_{ct}}}}{{{m_{dd}}}}.100\% = \frac{{79}}{{395}}.100\% = 20\% \)
5. Giải bài 42.5 trang 58 SBT Hóa học 8
Một dung dịch CuSO4 có khối lượng riêng là 1,206g/ml. Khi cô cạn 165,84ml dung dịch này người ta thu được 36g CuSO4. Hãy xác định nồng độ phần trăm của dung dịch CuSO4 đã dùng.
Phương pháp giải
- Bước 1: Tính khối lượng dung dịch ban đầu.
- Bước 2: Áp dụng công thức:
\(C\% \, = \frac{{{m_{ct}}}}{{{m_{{\text{dd}}}}}}.100\% \)
Hướng dẫn giải
Khối lượng dung dịch CuSO4 ban đầu:
mdd = V.D = 165,84.1,206 = 200(g)
Nồng độ % của dung dịch CuSO4:
\(C\% = \frac{{{m_{ct}}}}{{{m_{dd}}}}.100\% = \frac{{36}}{{200}}.100\% = 18\% \)
6. Giải bài 42.6 trang 58 SBT Hóa học 8
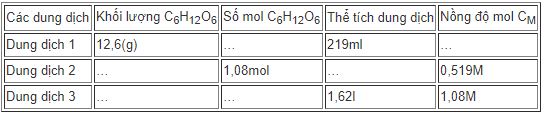
Hãy điền vào những ô trống của bảng những số liệu thích hợp của mỗi dung dịch glucozo C6H12O6 trong nước:
Phương pháp giải
Áp dụng công thức:
\({C_M} = \frac{n}{V}\)
\(C\% \, = \frac{{{m_{ct}}}}{{{m_{{\text{dd}}}}}}.100\% \)
Hướng dẫn giải
Dung dịch 1:
nC6H12O6 = 12,6 : 180 = 0,07 mol
V = 219 ml = 0,219 lít
⇒ \({C_{M({C_6}{H_{12}}{O_6})}} = \frac{n}{V} = \frac{{0,07}}{{0,219}} = 0,32M\)
Áp dụng các công thức:
m = n.M ⇒ \(n = \frac{m}{M}\)
\({C_M} = \frac{n}{V}\) ⇒ n = CM.V ; \(V = \frac{n}{{{C_M}}}\)
Để tính tương tự dung dịch 2, 3 ta được kết quả trong bảng trên.
7. Giải bài 42.7 trang 58 SBT Hóa học 8
Trình bày phương pháp thực nghiệm để xác định nồng độ phần trăm và nồng độ ml của mẫu dung dịch CuSO4 có sẵn trong phòng thí nghiệm.
Phương pháp giải
Áp dụng công thức:
\({C_M} = \frac{n}{V}\)
\(C\% \, = \frac{{{m_{ct}}}}{{{m_{{\text{dd}}}}}}.100\% \)
Hướng dẫn giải
- Phương pháp xác định nồng độ phần trăm dung dịch CuSO4
- Cân một lượng dung dịch CuSO4 xác định.
- Cô cạn dung dịch cho đến khi thu được chất rắn màu trắng đó là CuSO4. Sau đó đem cân lượng muối sau khi cô cạn này ta được số liệu là mct.
- Áp dụng công thức: \(C\% = \frac{{{m_{ct}}}}{{{m_{dd}}}}.100\% \) ta sẽ tính C% của dung dịch CuSO4.
- Phương pháp xác định nồng độ mol của dung dịch CuSO4:
- Đong 1 thể tích dung dịch CuSO4 xác định, đem cân lượng dung dịch đó.
- Sau đó dùng công thức \(n = \frac{m}{M}\) để tính số mol của CuSO4.
- Tính nồng độ mol của dung dịch CuSO4 bằng công thức: \({C_M} = \frac{n}{V}\)