Giải bài tập SBT Hóa 9 Bài 28: Các oxit của cacbon
Bài này sẽ giúp các em nắm vững được lý thuyết cũng như cách giải các bài tập của bài Các oxit của cacbon với cách làm đầy đủ, chi tiết và rõ ràng. Hy vọng đây sẽ là tài liệu tham khảo hữu ích cho các em học sinh
Mục lục nội dung
1. Giải bài 28.1 trang 34 SBT Hóa học 9
2. Giải bài 28.2 trang 34 SBT Hóa học 9
3. Giải bài 28.3 trang 34 SBT Hóa học 9
4. Giải bài 28.4 trang 35 SBT Hóa học 9
5. Giải bài 28.5 trang 35 SBT Hóa học 9
6. Giải bài 28.6 trang 35 SBT Hóa học 9
7. Giải bài 28.7 trang 35 SBT Hóa học 9
8. Giải bài 28.8 trang 35 SBT Hóa học 9
9. Giải bài 28.9 trang 36 SBT Hóa học 9
10. Giải bài 28.10 trang 36 SBT Hóa học 9
11. Giải bài 28.11 trang 36 SBT Hóa học 9

1. Giải bài 28.1 trang 34 SBT Hóa học 9
Có 4 lọ đựng 4 khí riêng biệt: oxi, hiđro, clo và cacbon đioxit. Dựa vào tính chất của các chất, làm thế nào để nhận biết được mỗi khí trên ?
Phương pháp giải
Dựa vào tính chất vật lí và hóa học khác nhau để nhận biết (dùng những hiện tượng đặc trưng).
Hướng dẫn giải
- Bình nào có khí màu vàng lục là khí Cl2.
- Lần lượt cho 3 khí còn lại lội qua dd Ca(OH)2 dư, khí nào cho kết tủa trắng là CO2.
CO2 + Ca(OH)2 → CaCO3 + H2O
- Trong 2 khí còn lại, khí nào làm bùng cháy tàn đóm đỏ là oxi, khí còn lại là H2.
2. Giải bài 28.2 trang 34 SBT Hóa học 9
So sánh tính chất hoá học của CO và CO2. Cho các thí dụ minh hoạ.
Phương pháp giải
Xem lại lí thuyết các oxit của cacon
Hướng dẫn giải
Giống nhau: CO và CO2 là oxit.
Khác nhau: CO2 là oxit axit : CO2 + Ca(OH)2 → CaCO3 + H2O.
CO là oxit trung tính.
CO2 là chất oxi hoá: C + CO2 → 2CO.
CO là chất khử: 2CO + O2 → 2CO2.
3. Giải bài 28.3 trang 34 SBT Hóa học 9
Một em học sinh làm thí nghiệm như sau: Cho một mẩu giấy quỳ tím vào ống nghiệm đựng nước cất, sau đó sục khí CO2 vào ống nghiệm. Màu của giấy quỳ tím có biến đổi không ? Nếu đun nóng nhẹ ống nghiệm thì màu của giấy quỳ tím biến đổi ra sao ? Hãy giải thích và viết các phương trình hoá học, nếu có.
Phương pháp giải
Xem lại tính chất hóa học của CO2
Hướng dẫn giải
Khí CO2 tan một phần vào nước tạo thành dung dịch H2CO3 làm quỳ tím chuyển sang màu đỏ. Khi đun nóng nhẹ, độ tan của CO2 trong nước giảm, CO2) bay ra khỏi dung dịch, giấy quỳ trở lại màu tím ban đầu.
4. Giải bài 28.4 trang 35 SBT Hóa học 9
Có những khí sau:
A. Cacbon đioxit
B. Clo
C. Hiđro
D. Cacbon oxit
E. Oxi
Hãy cho biết, khí nào
a) có thể gây nổ khi đốt cháy với oxi.
b) có tính chất tẩy màu khi ẩm.
c) làm đổi màu dung dịch quỳ tím.
d) làm bùng cháy tàn đóm đỏ
Phương pháp giải
Xem tính chất hóa học của các hợp chất.
Hướng dẫn giải
a) Khí có thể gây nổ khi đốt cháy với oxi là khí H2.
2H2 + O2 → 2H2O
b) Khí có tính chất tẩy màu khi ẩm là khí Cl2.
Cl2 + H2O → HClO + HCl
c) Khí làm đổi màu dung dịch quỳ tím là khí cacbon đioxit.
H2O + CO2 → H2CO3
d) Khí làm bùng cháy tàn đóm đỏ là khí oxi.
5. Giải bài 28.5 trang 35 SBT Hóa học 9
Nung nóng 19,15 gam hỗn hợp CuO và PbO với một lượng cacbon vừa đủ trong môi trường không có oxi để oxit kim loại bị khử hết. Toàn bộ lượng khí sinh ra được dẫn vào dung dịch Ca(OH)2 dư, phản ứng xong người ta thu được 7,5 gam chất kết tủa màu trắng.
a) Viết phương trình hoá học của các phản ứng đã xảy ra
b) Xác định thành phần phần trăm theo khối lượng của mỗi chất trong hỗn hợp ban đầu.
c) Tính khối lượng cacbon cần dùng cho phản ứng khử các oxit (Cho biết Cu : 64 ; Pb : 207.)
Phương pháp giải
Lập hệ phương trình hai ẩn là số mol của 2 oxit. Tính toán theo phương trình hóa học.
Hướng dẫn giải
a) Phương trình hóa học:
2CuO + C → 2Cu + CO2
2PbO + C → 2Pb + CO2
CO2 + Ca(OH)2 → CaCO3 + H2O
b) ta có:
nCaCO3 = 7,5/100 = 0,075
nCuO = x; nPbO = y
Ta có các phương trình: 80x + 223y = 19,15 (I)
x/2 + y/2 = 0,075 (l)
Giải phương trình (I), (II), ta được: X =0,1 ; Y=0,05
mCuO = 8g; mPbO = 11,15g
Vậy CuO chiếm 8/19,15 x 100% = 41% khối lượng hỗn hợp đầu, còn PbO chiếm: 59%
c) mCcần dùng = 0,075.12 = 0,9 (gam)
6. Giải bài 28.6 trang 35 SBT Hóa học 9
Người ta cần dùng 7,84 lít khí CO (đktc) để khử hoàn toàn 20 gam hỗn hợp CuO và Fe2O3 ở nhiệt độ cao.
a) Viết các phương trình hoá học.
b) Xác định thành phần phần trăm theo khối lượng của mỗi chất trong hỗn hợp trước và sau phản ứng.
Phương pháp giải
Lập và giải hệ phương trình 2 ẩn là số mol của hai oxit.
Hướng dẫn giải
a) Ta có phương trình hóa học:
CuO + CO to→ Cu + CO2
Fe2O3 + 3CO to→ 2Fe + 3CO2
b) Số mol CO = 7,84 : 22,4 = 0,35 mol
nCuO = x; nFe2O3 = y
Ta có phương trình:
x + 3y = 0,35
80x + 160y = 20
⇒ x = 0,05; y = 0,1
%mCuO = \(\frac{{80.0,05}}{{20}}.100\% = 20\% \)
%mFe2O3 = 100% - 20% = 80%
Vậy phần phần trăm theo khối lượng của mỗi chất trong hỗn hợp lần lượt là 20% và 80%.
7. Giải bài 28.7 trang 35 SBT Hóa học 9
Quá trình nào sau đây không sinh ra khí cacbonic ?
A. Đốt cháy khí đốt tự nhiên.
B. Sản xuất vôi sống.
C. Quá trình hô hấp của người và động vật.
D. Quang hợp của cây xanh.
Phương pháp giải
Xem chu trình của C trong tự nhiên (SGK).
Hướng dẫn giải
Quá trình quang hợp của cây xanh sinh ra khí O2
→ Đáp án D
8. Giải bài 28.8 trang 35 SBT Hóa học 9
Hàm lượng khí CO2 trong khí quyển của hành tinh chúng ta gần như là không đổi là vì
A. CO2 không có khả năng tác dụng với các chất khí khác trong không khí.
B. Trong quá trình quang hợp, cây xanh hấp thụ khí CO2, mặt khác một lượng CO2 được sinh ra do đốt cháy nhiên liệu, sự hô hấp của ngưòi và động vật...
C. CO2 hoà tan trong nước mưa.
D. CO2 bị phân hủy bởi nhiệt.
Phương pháp giải
Xem lại lí thuyết các oxit của cacbon.
Hướng dẫn giải
Hàm lượng khí CO2 trong khí quyển của hành tinh chúng ta gần như là không đổi là vì trong quá trình quang hợp, cây xanh hấp thụ khí CO2, mặt khác một lượng CO2 được sinh ra do đốt cháy nhiên liệu, sự hô hấp của ngưòi và động vật...
→ Đáp án B
9. Giải bài 28.9 trang 36 SBT Hóa học 9
Khí cacbon monooxit (CO) nguy hiểm là do có khả năng kết hợp với hemoglobin trong máu làm mất khả năng vận chuyển oxi của máu. Trong trường hợp nào sau đây, con người có thể bị tử vong do ngộ độc CO ?
A. Dùng bình gas để nấu nướng ở ngoài trời.
B. Đốt bếp lò trong nhà không được thông gió
C. Nổ (chạy) máy ôtô trong nhà xe đóng kín.
D. Cả trường hợp B và C.
Phương pháp giải
Xem lại lí thuyết về tính chất của CO
Hướng dẫn giải
Khí cacbon monooxit (CO) nguy hiểm là do có khả năng kết hợp với hemoglobin trong máu làm mất khả năng vận chuyển oxi của máu.
Con người có thể bị tử vong do ngộ độc CO khi đốt bếp lò trong nhà không được thông gió hoặc nổ (chạy) máy ôtô trong nhà xe đóng kín.
→ Đáp án D
10. Giải bài 28.10 trang 36 SBT Hóa học 9
Khí CO và CO2 bị coi là chất làm ô nhiễm môi trường vì
A. Nồng độ (%V) CO cho phép trong không khí là 10-20 phần triệu, nếu đến 50 phần triệu sẽ có hại cho não.
B. CO2 tuy không độc nhưng gây hiệu ứng nhà kính làm Trái Đất nóng lên.
C. CO2 cần cho cây xanh quang hợp nên không gây ô nhiễm.
D. Cả hai nguyên nhân A và B.
Phương pháp giải
Xem lại lí thuyết tính chất oxit của cacbon.
Hướng dẫn giải
Khí CO và CO2 bị coi là chất làm ô nhiễm môi trường vì nồng độ (%V) CO cho phép trong không khí là 10-20 phần triệu, nếu đến 50 phần triệu sẽ có hại cho não và CO2 tuy không độc nhưng gây hiệu ứng nhà kính làm Trái Đất nóng lên
→ Đáp án D
11. Giải bài 28.11 trang 36 SBT Hóa học 9
Cacbon và oxi phản ứng theo phương trình hoá học sau: C + O2 ⟶ CO2
Nếu cho 1,20 gam cacbon phản ứng với 1,68 lít khí oxi (đktc) thì lượng tối đa cacbon đioxit sinh ra là:
A. 1,8 lít
B. 1,68 lít
C. 1,86 lít
D. 2,52 lít
Phương pháp giải
Tính toán theo phương trình hóa học.
Hướng dẫn giải
Ta có:
nC = 1,2 : 12 = 0,1 (mol)
nO2 = 1,68 : 22,4 = 0,075 (mol)
Phương trình hóa học :
C + O2 ⟶ CO2
0,075 mol 0,075 mol 0,075 mol
Số mol C dư nên tính số mol CO2 và O2.
Theo phương trình hóa học trên, số mol CO2 là 0,075 mol
⇒ VCO2 = 1,68(l)
12. Giải bài 28.12 trang 36 SBT Hóa học 9
Khí CO sinh ra thường có lẫn một phần khí CO2. Hãy giới thiệu hai phương pháp hoá học có thể thu được khí CO trong phòng thí nghiệm và viết các phương trình hoá học.
Phương pháp giải
Dựa vào tính chất hóa học khác nhau giữa hai khí.
Hướng dẫn giải
- Dẫn hỗn hợp khí CO và CO2 đi qua dung dịch NaOH hoặc Ca(OH)2. Khí ra khỏi dung dịch kiềm là khí CO vì khí CO2 đã tác dụng với dung dịch NaOH hoặc Ca(OH)2.
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + Ca(OH)2 → CaCO3 + H2O
- Hoặc dẫn hỗn hợp khí qua canxi oxit (CaO), khí đi ra là khí CO.
13. Giải bài 28.13 trang 36 SBT Hóa học 9
Qua thí nghiệm ở hình vẽ 3.4, em hãy viết phương trình hoá học của phản ứng xảy ra. Phản ứng hoá học này thuộc loại phản ứng nào ?
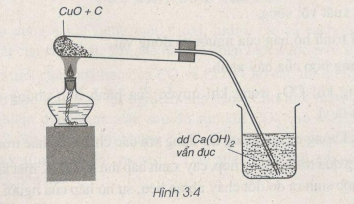
Phương pháp giải
Xem lại lí thuyết tính chất hóa học của C.
Hướng dẫn giải
Phương trình hóa học: 2CuO + C to→ CO2 + 2Cu
Phản ứng này là phản ứng oxi hóa - khử.
CO2 + Ca(OH)2 → CaCO3 + H2O
Tham khảo thêm
- doc Giải bài tập SBT Hóa 9 Bài 25: Tính chất của phi kim
- doc Giải bài tập SBT Hóa 9 Bài 26: Clo
- doc Giải bài tập SBT Hóa 9 Bài 27: Cacbon
- doc Giải bài tập SBT Hóa 9 Bài 29: Axit cacbonic và muối cacbonat
- doc Giải bài tập SBT Hóa 9 Bài 30: Silic. Công nghiệp silicat
- doc Giải bài tập SBT Hóa 9 Bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
- doc Giải bài tập SBT Hóa 9 Bài 32: Luyện tập Chương 3
