Giải bài tập SBT Hóa 9 Bài 39: Benzen
Dưới đây là nội dung chi tiết Giải bài tập SBT Hóa 9 Chương 4 Benzen, với hướng dẫn giải chi tiết, rõ ràng, trình bày khoa học. eLib hy vọng đây sẽ là tài liệu hữu ích giúp các bạn học sinh lớp 9 học tập thật tốt!
Mục lục nội dung

1. Giải bài 39.1 trang 49 SBT Hóa học 9
Benzen không làm mất màu dung dịch brom vì
A. benzen là chất lỏng.
B. phân tử có cấu tạo vòng.
C. phân tử có 3 liên kết đôi.
D. phân tử có cấu tạo vòng, trong đó có 3 liên kết đôi xen kẽ ba liên kết đơn.
Phương pháp giải
Xem lại lí thuyết về benzen
Benzen C6H6 là chất lỏng, không màu, nhẹ hơn nước, không tan trong nước, hòa tan nhiều chất như: dầu ăn, cao su, nến, iot.., có tính độc.
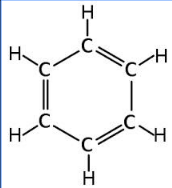
Sáu nguyên tử C trong phân tử benzen liên kết với nhau tạo thành mạch vòng sáu cạnh đều, có ba liên kết đôi xen kẽ ba liên kết đơn.
Hướng dẫn giải
Benzen không làm mất màu dung dịch brom vì phân tử có cấu tạo vòng, trong đó có 3 liên kết đôi xen kẽ ba liên kết đơn
Đáp án D.
2. Giải bài 39.2 trang 49 SBT Hóa học 9
Cho benzen vào ống nghiệm đựng dung dịch brom, lắc đều sau đó để yên thấy chất lỏng trong ống nghiệm
A. là đồng nhất và có màu của dung dịch brom.
B. tách thành hai lớp và đều có màu.
C. tách thành hai lớp, lớp ở trên không màu.
D. là đồng nhất và không có màu.
Phương pháp giải
Xem lại tính chất của benzen
Benzen khó tham gia phản ứng cộng (không phản ứng với dd brom)
Hướng dẫn giải
Cho benzen vào ống nghiệm đựng dung dịch brom, lắc đều sau đó để yên thấy chất lỏng trong ống nghiệm tách thành hai lớp và đều có màu.
Đáp án B.
3. Giải bài 39.3 trang 49 SBT Hóa học 9
Đốt cháy cùng 1 gam các chất CH4, C2H4, C2H2, C6H6 thu được khí CO2 với khối lượng tương ứng là a, b, c, d gam. Trật tự của a, b, c, d là
A. a < b < c < d;
B. b < a < d < c;
C. a < b
D. c = d < b < a.
Phương pháp giải
Áp dụng định luật bào toàn nguyên tố để làm nhanh
Hướng dẫn giải
Cách 1:
Áp dụng bảo toàn nguyên tố C có:
Số mol của CH4 là: \(\dfrac{{1}}{{16}}\)
→ số mol CO2 là: \(\dfrac{{1}}{{16}}\)
Số mol của C2H4 là: \(\dfrac{{1}}{{28}}\)
→ số mol CO2 là: \(\dfrac{{2 \times 1}}{{28}} = \dfrac{{1}}{{14}}\)
Số mol của C2H2 là: \(\dfrac{{1}}{{26}}\)
→ số mol CO2 là: \(\dfrac{{2 \times 1}}{{26}} = \dfrac{{1}}{{13}}\)
Số mol của C6H6 là: \(\dfrac{{1}}{{78}}\)
→ số mol CO2 là: \(\dfrac{{2 \times 1}}{{78}} = \dfrac{{1}}{{39}}\)
Cách 2:
CH4 → CO2
16g 44g
1g 44/16g = a
C2H4 → 2CO2
28g 88g
1g 88/28g = 22/7 = b
C2H2 → 2CO2
26g 88g
1g 88/26g = 44/13g = c
C6H6 → 6CO2
78g 264g
1g 264/78 = 44/13g = d
→ a < b < c = d
4. Giải bài 39.4 trang 49 SBT Hóa học 9
Đốt cháy hiđrocacbon A, người ta thu được CO2 và H2O theo tỉ lệ mCO2 : mH2O = 44 : 9. Biết A không làm mất màu dung dịch brom. Hỏi A là hiđrocacbon nào trong số các hiđrocacbon sau ?
CH ≡CH ; CH3 - CH3 ; CH2 = CH - C = CH ; CH2 = CH2 ;
Phương pháp giải
- Tỉ lệ mol CO2 : H2O = 1 : 0,5 → Số mol CO2 > số mol H2O nên A là hiđrocacbon không no có ít nhất hai liên kết π, mà A không làm mất màu nước brom nên A không có liên kết π dạng mạch hở.
Hướng dẫn giải
Cách 1:
Ta có: tỉ lệ mol CO2 : H2O = 1 : 0,5 → Số mol CO2 > số mol H2O nên A là hiđrocacbon không no có ít nhất hai liên kết π, mà A không làm mất màu nước brom nên A không có liên kết π dạng mạch hở
→ A phải là:
Cách 2:
Gọi công thức phân tử của A là CxHy
\({C_x}{H_y}\xrightarrow{{ + {O_2}}}xC{O_2} + \frac{y}{2}{H_2}O$\)
Theo đề bài ta có 44x : 9y = 44 : 9
→ x : y = 1:1 → C6H6
5. Giải bài 39.5 trang 49 SBT Hóa học 9
a) Để đốt cháy 0,1 mol benzen cần dùng bao nhiêu lít oxi ở đktc ? Bao nhiêu lít không khí ở đktc ?
b) Từ kết quả trên hãy giải thích tại sao khi benzen cháy trong không khí lại sinh ra nhiều muội than.
Phương pháp giải
Viết và tính toán theo phương trình hóa học. Xem tính chất hóa học của benzen
Hướng dẫn giải
a) Phản ứng cháy của benzen:
2C6H6 + 15O2 → 12CO2 + 6H2O
nO2 = 0,75 mol
VO2 = 0,75.22,4 = 16,8 lít
Nếu dùng không khí thì \({V_{kk}} = \frac{{16,8}}{{20}}.100 = 84\) lít
b) Vậy để đốt cháy 0,1 mol benzen cần một lượng không khí khá lớn nên khi benzen cháy trong không khí thường sinh ra muội than vì thiếu oxi.
6. Giải bài 39.6 trang 49 SBT Hóa học 9
Trong những hiđrocacbon sau : CH3-CH2-CH3; CH2=CH2; CH3-CH3; CH≡CH; C6H6 (benzen) những chất nào có phản ứng thế với brom? Có phản ứng cộng với brom? Viết phương trình hoá học minh hoạ và ghi rõ điều kiện phản ứng?
Phương pháp giải
Xem tính chất hóa học của một số hiđrocacbon đã học.
Hướng dẫn giải
Chất có phản ứng thế với brom khi chiếu sáng CH3-CH2-CH3 ; CH3-CH3.
- Phản ứng thế với brom khi có mặt bột sắt và đun nóng: C6H6 (benzen).
- Chất có phản ứng cộng với brom (trong dung dịch): CH2 = CH2 ; CH ≡CH.
7. Giải bài 39.7 trang 50 SBT Hóa học 9
Khi có mặt bột sắt, benzen phản ứng với clo tương tự như phản ứng với brom. Hãy tính lượng clobenzen thu được khi cho 15,6 gam benzen tác dụng với clo dư khi có mặt bột Fe và đun nóng. Biết hiệu suất phản ứng đạt 80%.
Phương pháp giải
Viết và tính theo phương trình hóa học.
Hướng dẫn giải
Phương trình hoá học của phản ứng giữa benzen và clo
C6H6 + Cl2 to→ C6H5Cl + HCl
Theo phương trình hoá học: số mol C6H6 = số mol C6H5Cl.
Vì hiệu suất 80% và clo dư nên số mol clobenzen thu được là :
nC6H5Cl = \(\frac{{15,6}}{{78}}.\frac{{80}}{{100}} = 0,16mol\)
⇒ mC6H5Cl = 0,16.112,5 = 18g
Tham khảo thêm
- doc Giải bài tập SBT Hóa 9 Bài 34: Khái niệm về hợp chất hữu cơ và hóa học hữu cơ
- doc Giải bài tập SBT Hóa 9 Bài 35: Cấu tạo phân tử hợp chất hữu cơ
- doc Giải bài tập SBT Hóa 9 Bài 36: Metan
- doc Giải bài tập SBT Hóa 9 Bài 37: Etilen
- doc Giải bài tập SBT Hóa 9 Bài 38: Axetilen
- doc Giải bài tập SBT Hóa 10 Bài 40: Dầu mỏ và khí thiên nhiên
- doc Giải bài tập SBT Hóa 9 Bài 41: Nhiên liệu
- doc Giải bài tập SBT Hóa 9 Bài 42: Luyện tập chương 4