Giải bài tập SBT Hóa 9 Bài 36: Metan
Giải bài tập Metan được eLib sưu tầm và tổng hợp bên dưới đây. Tài liệu là lời giải hay, chi tiết và chính xác cho các bài tập trong SBT trang 46. Hi vọng tài liệu sẽ giúp ích cho quá trình học tập và nâng cao kiến thức của các bạn học sinh. Mời các bạn tham khảo tài liệu dưới đây chuẩn bị cho bài học sắp tới
Mục lục nội dung

1. Giải bài 36.1 trang 45 SBT Hóa học 9
Trong tự nhiên khí metan có nhiều trong
A. khí quyển
B. mỏ khí, mỏ dầu, mỏ than
C. nước biển
D. nước ao
Phương pháp giải
Xem lại lí thuyết metan.
Hướng dẫn giải
Trong tự nhiên khí metan có nhiều trong mỏ khí, mỏ dầu, mỏ than
→ Đáp án B
2. Giải bài 36.2 trang 45 SBT Hóa học 9
Đốt cháy hoàn toàn 11,2 lít hỗn hợp khí gồm CH4 và H2 ở đktc thu được 16,2 gam H2O.
a) Viết các phương trình hoá học.
b) Tính thành phần phần trăm theo thể tích của mỗi khí trong hỗn hợp.
c) Tính thể tích khí CO2 tạo ra ở đktc.
Phương pháp giải
Viết PTHH và lập hệ phương trình hai ẩn là số mol của metan và hiđro.
\(C{H_4} + 2{O_2}\buildrel {{t^o}} \over\longrightarrow C{O_2} + 2{H_2}O\)
\(2{H_2} + {O_2}\buildrel {{t^o}} \over\longrightarrow 2{H_2}O\)
Hướng dẫn giải
Từ (1) và (2), ta có hệ phương trình:
22,4x + 22,4y = 11,2 và 2x + y = 0,9
Giải hệ phương trình ta có: x = 0,4 (mol); y= 0,1 (mol)
b) Gọi x là số mol của CH4 ⇒ VCH4 = n.22,4 = 22,4x
y là số mol của H2 ⇒ VH2 = 22,4y
Vhh = VH2 + VCH4 ⇒ 22,4x + 22,4y = 11,2 (1)
nH2O = m/M = 16,2/18 = 0,9 mol
nH2O = 2x + y = 0,9 (2)
c) nCO2 = 0,4mol
Thể tích của khí CO2: VCO2 = 0,4.22,4 = 8,96 lít
3. Giải bài 36.3 trang 46 SBT Hóa học 9
Ở điều kiện tiêu chuẩn, 2 lít hiđrocacbon A có khối lượng bằng 1 lít khí oxi. Hãy xác định công thức phân tử của A.
Phương pháp giải
Đo ở cùng điều kiện tiêu chuẩn, tỉ lệ về thể tích bằng tỉ lệ về số mol. Tức là 2 mol A có khối lương bằng 1 mol oxi ⇒ MA
Hướng dẫn giải
Theo đề bài: 22,4 lít O2 có khối lượng bằng 44,8 lít hiđrocacbon A. Vậy 2 mol A có khối lượng bằng 1 mol oxi
⇒ MA = 16 gam
⇒ công thức phân tử của A là CH4.
4. Giải bài 36.4 trang 46 SBT Hóa học 9
Nêu phương pháp hoá học dùng để phân biệt các khí đựng trong các bình riêng biệt sau:
a) Metan, hiđro, oxi.
b) Metan, cacbon đioxit, hiđro.
c) Metan, cacbon oxit, hiđro.
Phương pháp giải
Dựa vào tính chất hóa học đặc trưng của các chất để xác định
a. Metan cháy sinh ra CO2 dẫn vào nước vôi trong dư thấy xuất hiện kết tủa; hiđro cháy cho ngọn lửa màu xanh, còn lại là oxi.
b. Dùng nước vôi trong nhận ra CO2 vì làm dung dịch vẩn đục; đốt cháy 2 khí còn lại, dẫn qua nước vôi trong dư thấy xuất hiện kết tủa thì ban đầu là metan, còn lại là H2
c. Đốt các khí, hiđro không sinh ra CO2 chỉ có metan và CO; đem ngưng tụ sản phẩm nếu xuất hiện hơi nước thì ban đầu là metan
Hướng dẫn giải
a) Đốt các khí:
Khí không cháy là oxi, khí cháy tạo ra CO2 (nhận được nhờ dung dịch Ca(OH)2) là CH4. Khí còn lại là H2.
b) Nhận ra CO2 nhờ dung dịch Ca(OH)2, phân biệt CH4 và H2 tương tự câu a.
c) Đốt các khí. Khí không sinh ra CO2 là H2. Hai khí cháy sinh ra CO2 đó là CH4 và CO.
Làm lạnh sản phẩm cháy khi đốt CH4 và CO, trường hợp nào sinh ra H2O, đó là CH4. Khí còn lại là CO.
5. Giải bài 36.5 trang 46 SBT Hóa học 9
Propan là hiđrocacbon có tính chất tương tự metan và có công thức phân tử C3H8
a) Viết công thức cấu tạo của propan.
b) Viết phương trình hoá học của phản ứng đốt cháy propan.
c) Viết phương trình hoá học của phản ứng giữa propan và clo khi chiếu sá để tạo ra C3H7Cl.
Phương pháp giải
- Trong công thức cấu tạo C3H8 gần giống với metan, hơn metan 2 nhóm CH2
- Propan cháy sinh ra CO2 và H2O.
- Propan tham gia phản ứng thế, thay nguyên tử H bằng nguyên tử Cl, tạo ra C3H7Cl và HCl.
Hướng dẫn giải
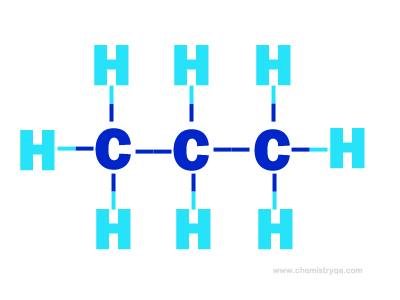
a) Công thức cấu tạo của propan là C3H8
b) C3H8 + 5O2 to→ 3CO2 + 4H2O
c) C3H8 + Cl2 a/s→ C3H7Cl + HCl
6. Giải bài 36.6 trang 46 SBT Hóa học 9
Khi cho metan tác dụng với clo có chiếu sáng theo tỉ lệ 1:1 về số mol, người thấy ngoài sản phẩm chính là CH3Cl còn tạo ra một hợp chất X trong phần trăm khối lượng của clo là 83,53%. Hãy xác định công thức phân tử của X.
Phương pháp giải
Gọi sản phẩm còn lại là CH4-aCla từ phần trăm khối lượng của clo tính được a.
Hướng dẫn giải
Sản phẩm tạo ra có công thức: CH4-aCla
⇒ \(\frac{{35,5a}}{{12 + 4 - a + 35,5a}}.100\% = 83,53\)
⇒ a = 2.
Vậy công thức của X là CH2Cl2
7. Giải bài 36.7 trang 46 SBT Hóa học 9
Hỗn hợp X gồm CH4 và hiđrocacbon A. Đốt cháy hoàn toàn 4,48 lít hỗn hợp X rồi cho toàn bộ sản phẩm thu được hấp thụ hết vào dung dịch Ca(OH)2 dư thấy tạo ra 50 gam kết tủa và khối lượng bình đựng dung dịch Ca(OH)2 tăng thêm 34,6 gam.
Xác định công thức phân tử của A, biết trong hỗn hợp số mol của A gấp lần số mol của CH4.
Phương pháp giải
- Gọi công thức của A là CnHm
- Tính được số mol của CH4 và x, tính số mol CO2 và H2O do CH4 cháy sinh ra.
- Tính được số mol CO2 và H2O do hỗn hợp X cháy sinh ra: số mol CO2 dựa vào kết tủa, khối lượng bình tăng bằng tổng khối lượng CO2 và H2O → khối lượng và số mol H2O → số mol CO2 và H2O do A sinh ra → Tìm n,m (BTNT C, H).
Hướng dẫn giải
Ta có:
nX = 4,48 : 22,4 = 0,2 mol
⇒ nCH4 = 0,2 : 4 = 0,05 mol; nA = 0,05.3 = 0,15 mol
Phương trình hóa học: CH4 + 2O2 → CO2 + 2H2O
CnHm + (n+m/4)O2 to→ nCO2 + m/2H2O
CO2 + Ca(OH)2 → CaCO3 + H2O
nCO2 = nCaCO3 = 50 : 100 = 0,5 mol ⇒ nCO2, nH2O tạo ra khi đốt cháy A là
nCO2 = 0,5 - 0,05 = 0,45 mol; nH2O = 0,7 - 0,1 = 0,6 mol
⇒ Công thức của A là C3H8
Tham khảo thêm
- doc Giải bài tập SBT Hóa 9 Bài 34: Khái niệm về hợp chất hữu cơ và hóa học hữu cơ
- doc Giải bài tập SBT Hóa 9 Bài 35: Cấu tạo phân tử hợp chất hữu cơ
- doc Giải bài tập SBT Hóa 9 Bài 37: Etilen
- doc Giải bài tập SBT Hóa 9 Bài 38: Axetilen
- doc Giải bài tập SBT Hóa 9 Bài 39: Benzen
- doc Giải bài tập SBT Hóa 10 Bài 40: Dầu mỏ và khí thiên nhiên
- doc Giải bài tập SBT Hóa 9 Bài 41: Nhiên liệu
- doc Giải bài tập SBT Hóa 9 Bài 42: Luyện tập chương 4
