Hoá học 8 Bài 40: Dung dịch
Trong thí nghiệm hóa học hoặc trong đời sống hàng ngày các em thường hòa tan nhiều chất như đường, muối, ... vào nước ta được dung dịch đường, muối,...Vậy dung dịch là gì? Ta cùng nhau tìm hiểu trong bài giảng Dung dịch sau:
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Dung môi - Chất tan - Dung dịch
a) Thí nghiệm 1: Hòa tan đường vào trong nước ta thu được dung dịch nước đường

Nhận xét: Tinh thể đường tan trong nước tạo dung dịch trong suốt, không phân biệt được đâu là đường đâu là nước.
Kết luận:
+ Chất tan: Đường
+ Dung môi: Nước
+ Dung dịch: Nước đường
b) Thí nghiệm 2: Tính tan của dầu ăn và xăng trong nước
- Một số hình ảnh minh họa tính tan của dầu ăn và xăng trong nước

- Các em chú ý quan sát hiện tượng quan sát được khi cho dầu ăn vào nước và trong dung môi hữu cơ như xăng, CCl4, ...
Video 1: So sánh sự hòa tan dầu ăn trong dung môi hữu cơ
- Nhận xét: Dầu ăn không hòa tan trong nước nhưng lại tan được trong dung môi hữu cơ như xăng, CCl4,...
- Kết luận:
+ Dung môi: là chất có khả năng hòa tan chất khác để tạo thành dung dịch
+ Chất tan: là chất bị hòa tan trong dung môi
+ Dung dịch là hỗn hợp đồng nhất giữa dung môi và chất tan
1.2. Dung dịch chưa bão hòa. Dung dịch bão hòa
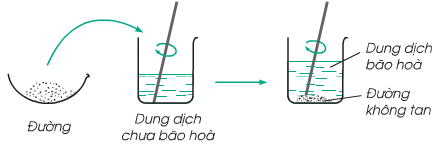
Nhận xét:
- Ở giai đoạn đầu: ta được dung dịch đường, dung dịch này vẫn có thể hòa tan thêm đường ⇒ Dung dịch chưa bão hòa
- Ở giai đoạn sau: cứ hòa tan mãi đường thì đến thời điểm không thể hòa tan thêm được nữa ⇒ Dung dịch bão hòa
Kết luận: Ở nhiệt độ xác định:
- Dung dịch chưa bão hòa là dung dịch có thể hòa tan thêm chất tan
- Dung dịch bão hòa là dung dịch không thể hòa tan thêm chất tan
1.3. Làm thế nào để quá trình hòa tan chất rắn trong nước xảy ra nhanh hơn?
a) Khuấy dung dịch
Khuấy dung dịch tạo ra tiếp xúc mới giữa phân tử chất rắn và các phân tử nước ⇒ Sự hòa tan diễn ra nhanh hơn

b) Đun nóng dung dịch
Ở nhiệt độ càng cao, các phân tử chuyển động càng nhanh làm tăng số lần va chạm giữa các phân tử nước và bề mặt chất rắn ⇒ Sự hòa tan diễn ra nhanh hơn

c) Nghiền nhỏ chất rắn
Nghiền nhỏ chất rắn làm tăng diện tích tiếp xúc giữa chất rắn và phân tử nước ⇒ Kích thước của vật rắn càng nhỏ thì sự hòa tan diễn ra càng nhanh

2. Bài tập minh họa
Xác định dung dịch bão hòa
Bài 1: Biết rằng ở nhiệt độ phòng thí nghiệm (200C) 10g nước có thể hòa tan tối đa 20g đường; 3,6g muối ăn.
a) Trộn 15 g đường vào 10g nước ta thu được dung dịch bão hòa chưa? Vì sao?
b) Trộn 4,5g muối vào 10g nước ta thu được dung dịch bão hòa chưa? Vì sao?
Hướng dẫn giải
a) 10g nước hòa tan tối đa 20g đường mà đề cho có 15 gam đường. Vậy ta thu được dung dịch chưa bão hòa.
b) 10g nước hòa tan tối đa 3,6g muối ăn mà đề cho những 4,5 gam muối. Vậy ta thu được dung dịch bão hòa.
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Làm sao để quá trình hòa tan chất rắn vào nước diễn ra nhanh hơn?
Câu 2: Chất tan tồn tại ở dạng?
Câu 3: Vì sao đun nóng dung dịch cũng là một phương pháp để chất rắn tan nhanh hơn trong nước?
Câu 4: Khi hòa tan dầu ăn trong cốc xăng thì xăng đóng vai trò gì?
Câu 5: Khi cho đường vào nước rồi đun lên, độ tan của đường trong nước sẽ thay đổi như thế nào?
3.2. Bài tập trắc nghiệm
Câu 1: Chọn câu đúng
A. Dung dịch là hợp chất đồng nhất của dung môi và chất tan
B. Nước đừơng không phải là dung dịch
C. Dầu ăn tan được trong nước
D. Có 2 cách để chất rắn hòa tan trong nước
Câu 2: Xăng có thể hòa tan
A. Nước
B. Dầu ăn
C. Muối biển
D. Đường
Câu 3: Hai chất không thể hòa tan với nhau tạo thành dung dịch là
A. Nước và đường
B. Dầu ăn và xăng
C. Rượu và nước
D. Dầu ăn và cát
Câu4: Chất tan tồn tại ở dạng
A. Chất rắn
B. Chất lỏng
C. Chất hơi
D. Chất rắn, lỏng, khí
Câu 5: Vì sao đúng nóng dung dịch cũng là một phương pháp để chất rắn tan nhanh hơn trong nước
A. Làm mềm chất rắn
B. Có áp suất cao
C. Ở nhiệt độ cao, các phân tử nước chuyển động nhanh hơn làm tang số lần va chạm giữa các phân tử và bề mặt chất rắn
D. Do nhiệt độ cao
4. Kết luận
Sau bài học cần nắm:
- Khí hiđrô tác dụng được với oxi ở dạng đơn chất, phản ứng này toả nhiệt; biết hỗn hợp khí hiđrô và oxi là hỗn hợp nổ
- Cách đốt cháy hiđrô trong không khí, biết cách thử hiđrô nguyên chất và qui tắc an toàn khi đốt cháy hiđrô, biết viết phương trình hóa học của hiđrô với oxi.
