Giải bài tập SGK Hóa 11 Bài 10: Photpho
Nội dung hướng dẫn Giải bài tập Hóa 11 Bài 10 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về photpho. Mời các em cùng theo dõi.
Mục lục nội dung

1. Giải bài 1 trang 49 SGK Hóa học 11
Nêu những điểm khác nhau về tính chất vật lí giữa P trắng và P đỏ. Trong điều kiện nào P trắng chuyển thành P đỏ và ngược lại?
Phương pháp giải
Để trả lời câu hỏi trên cần nắm rõ tính chất vật lí của P trắng và P đỏ.
Hướng dẫn giải
- Những điểm khác nhau về tính chất vật lí giữa P trắng và P đỏ:
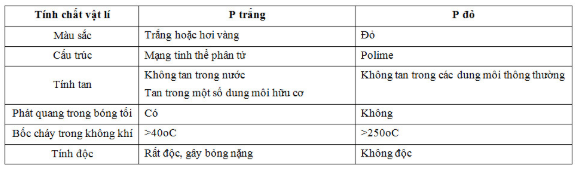
- Sự chuyển đổi giữa P trắng và P đỏ:

2. Giải bài 2 trang 49 SGK Hóa học 11
Lập phương trình hóa học của các phản ứng sau đây và cho biết trong các phản ứng này, P có tính khử hay tính oxi hóa:
P + O2 → P2O5
P + Cl2 → PCl3
P + S → P2S3
P + S → P2S5
P + Mg → Mg3P2
P + KClO3 → P2O5 + KCl
Phương pháp giải
Để lập phương trình hóa học cần xác định chất oxi hóa và chất khử sau đó cân bằng phương trình theo phương pháp thăng bằng electron.
Hướng dẫn giải
- P + O2 → P2O5
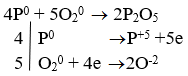
→ P là chất khử
- P + Cl2 → PCl3
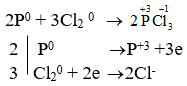
→ P là chất khử
- P + S → P2S3
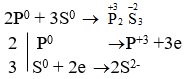
→ P là chất khử
P + S → P2S5
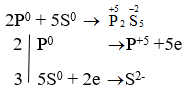
→ P là chất khử
- P + Mg → Mg3P2
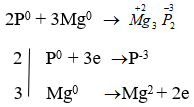
→ P là chất oxi hóa
- P + KClO3 → P2O5 + KCl
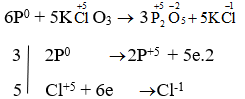
→ P là chất khử
3. Giải bài 3 trang 49 SGK Hóa học 11
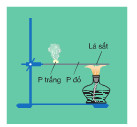
Thí nghiệm ở hình 2.13 chứng minh khả năng bốc cháy khác nhau của P trắng và P đỏ. Hãy quan sát, mô tả và giải thích hiện tượng xảy ra trong thí nghiệm. Viết phương trình hóa học của phản ứng xảy ra.
Phương pháp giải
Để mô tả và giải thích hiện tượng xảy ra trong thí nghiệm trên cần nắm rõ tính chất hóa học và đặc điểm cấu trúc mạng tinh thể của P trắng và P đỏ.
Hướng dẫn giải
Khả năng bốc cháy khác nhau của P trắng và P đỏ:
Hiện tượng: P trắng bốc cháy, còn P đỏ không bốc cháy.
Giải thích:
- Do P trắng có cấu trúc mạng tinh thể phân tử còn P đỏ có cấu trúc polime nên P trắng hoạt động hóa học mạnh hơn P đỏ.
- P trắng tác dụng với oxi không khí dễ dàng hơn, tạo thành P2O5:
4P + 5O2 → 2P2O5
4. Giải bài 4 trang 50 SGK Hóa học 11
Nêu những ứng dụng của photpho. Những ứng dụng đó xuất phát từ tính chất gì của photpho?
Phương pháp giải
Để trả lời câu hỏi trên nắm rõ ứng dụng của photpho.
Hướng dẫn giải
- Ứng dụng của photpho:
- Phần lớn Photpho sản xuất ra dùng để sản xuất axit photphoric, phần còn lại chủ yếu dùng để sản xuất diêm.
- Photpho còn được dùng vào mục đích quân sự: sản xuất bom, đạn cháy, đạn khói...
- Photpho còn là một nguyên tố rất cần cho con người, nhất là trí thông minh và phát triển xương. Cần cho cây, nhất là cây ăn quả.
- Mỗi ứng dụng đó xuất phát từ tính khử hoặc tính oxi hóa của photpho.
5. Giải bài 5 trang 50 SGK Hóa học 11
Đốt cháy hoàn toàn 6,2 gam photpho trong oxi dư. Cho sản phẩm tạo thành tác dụng vừa đủ với dung dịch NaOH 32% tạo ra muối Na2HPO4.
a) Viết phương trình hóa học của các phản ứng xảy ra.
b) Tính khối lượng dung dịch NaOH đã dùng.
c) Tính nồng độ phần trăm của muối trong dung dịch thu được sau phản ứng.
Phương pháp giải
- Dựa theo các dữ kiện đề bài để viết các PTHH xảy ra.
- Tính toán theo PTHH.
Hướng dẫn giải
Câu a: Phương trình hóa học của các phản ứng xảy ra
4P + 5O2 → 2P2O5 (1)
P2O5 + 4NaOH → 2Na2HPO4 + H2O (2)
Câu b: Khối lượng dung dịch NaOH đã dùng
Số mol P tham gia phản ứng:
\({n_P} = \frac{{6,2}}{{31}} = 0,2mol\)
Từ (1) và (2) có sơ đồ hợp thức:
2P → P2O5 → 4NaOH → 2Na2HPO4 (3)
2 mol 1 mol 4 mol 2 mol
0,200 mol 0,100 mol 0,400 mol 0,200 mol
mNaOH = 0,4.40 = 16 gam
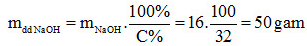
Câu c: Nồng độ phần trăm của muối trong dung dịch thu được sau phản ứng
Dựa vào (3) tính được 0,200 mol Na2HPO4.
Khối lượng dung dịch Na2HPO4 = 14,2 + 50 = 64,2 gam
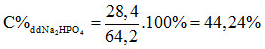
Tham khảo thêm
- doc Giải bài tập SGK Hóa 11 Bài 7: Nitơ
- doc Giải bài tập SGK Hóa 11 Bài 8: Amoniac và muối amoni
- doc Giải bài tập SGK Hóa 11 Bài 9: Axit nitric và muối nitrat
- doc Giải bài tập SGK Hóa 11 Bài 11: Axit photphoric và muối photphat
- doc Giải bài tập SGK Hóa 11 Bài 12: Phân bón hóa học
- doc Giải bài tập SGK Hóa 11 Bài 13: Luyện tập: Tính chất của nitơ, photpho và hợp chất của chúng
