Giải bài tập SGK Hóa 11 Bài 45: Axit cacboxylic
Để các em có thêm nhiều tài liệu tham khảo hữu ích chúng tôi xin giới thiệu đến các em học sinh nội dung giải bài tập SGK môn Hóa học 11 dưới đây. Tài liệu được eLib biên soạn và tổng hợp với nội dung các bài tập có phương pháp và hướng dẫn giải đầy đủ chi tiết, rõ ràng. Mời các em cùng tham khảo.
Mục lục nội dung
1. Giải bài 1 trang 210 SGK Hóa học 11
Thế nào là axit cacboxylic? Viết công thức cấu tạo, gọi tên các axit có công thức phân tử C4H8O2.
Phương pháp giải
Xem lại lý thuyết về axit cacboxylic, cách viết công thức cấu tạo và gọi tên
Hướng dẫn giải
- Axit cacboxylic: là những hợp chất hữu cơ mà phân tử có nhóm cacboxyl (-COOH) liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hiđro.
- CTCT của các axit có CTPT C4H8O2 là:
CH3-CH2-CH2-COOH :axit butiric
CH3-CH(CH3)-COOH :axit isobutiric (2-metylpropanoic)
2. Giải bài 2 trang 210 SGK Hóa học 11
Từ công thức cấu tạo, hãy giải thích tại sao axit fomic có tính chất của một anđehit.
Phương pháp giải
Tính chất hóa học của andehit gây ra bởi nhóm chức -CHO => phải giải thích được trong phân tử của HCOOH cũng có nhóm này
Hướng dẫn giải
Công thức cấu tạo của axit fomic HCHO
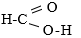
Do phân tử có chứa nhóm -CHO nên axit fomic có tính chất của một anđehit.
3. Giải bài 3 trang 210 SGK Hóa học 11
Từ metan và các chất vô cơ cần thiết khác có thể điều chế được axit fomic, axit axetic. Viết phương trình hóa học của các phản ứng xảy ra.
Phương pháp giải
Điều chế được axit fomic và axit axetic từ metan
Hướng dẫn giải
HCOOH:
CH4 + O2 → HCHO + H2O
HCHO + 1/2O2 → HCOOH
CH3COOH:
CH4 + O2 → HCHO + H2O
HCHO + H2 → CH3OH
CH3OH + CO → CH3COOH
4. Giải bài 4 trang 210 SGK Hóa học 11
Chất Y có công thức phân tử C4H8O2 tác dụng với NaOH tạo thành chất Z (C4H7O2Na). Vậy Y thuộc loại hợp chất nào sau đây?
A. Anđehit.
B. Axit.
C. Ancol.
D. Xeton.
Phương pháp giải
Y tác dụng được với NaOH vậy Y chỉ có thể là axit
Hướng dẫn giải
Chất Y tác dụng với NaOH tạo thành chất Z (C4H7O2Na) → Vậy Y thuộc loại hợp chất axit
CH3CH2CH2COOH + NaOH → CH3CH2CH2COONa + H2O
⇒ Đáp án B.
5. Giải bài 5 trang 210 SGK Hóa học 11
Để trung hòa 150,0 gam dung dịch 7,40% của axit no, mạch hở, đơn chức X cần dùng 100,0 ml dung dịch NaOH 1,50M. Viết công thức cấu tạo và gọi tên của chất X.
Phương pháp giải
Tính khối lượng axit \({{\rm{m}}_{axit}} = \frac{{{m_{dd}}.C\% }}{{100\% }} = ?\)
Gọi CTCT của axit no, mạch hở, đơn chức là CnH2n+1COOH ( n ≥ 0)
CnH2n+1COOH + NaOH → CnH2n+1COONa + H2O
nCnH2n+1COOH = nNaOH = ? (mol)
→ MCnH2n+1COOH = maxit : nCnH2n+1COOH = ?
→ CTPT và CTCT của axit
Hướng dẫn giải
\({\operatorname{m} _{axit}} = \dfrac{{150.7,4\% }}{{100\% }} = 11,1\,(gam)\)
nNaOH = 0,1.1,5 = 0,15 (mol)
Gọi CTCT của axit no, mạch hở, đơn chức là CnH2n+1COOH ( n ≥ 0)
CnH2n+1COOH + NaOH → CnH2n+1COONa + H2O
nCnH2n+1COOH = nNaOH = 0,15 (mol)
→ MCnH2n+1COOH = maxit : nCnH2n+1COOH = 11,1 : 0,15 = 74 (g/mol)
→ 14n + 46 = 74
→ n =2
Vậy CTCT của axit là C2H5COOH: axit propionic
6. Giải bài 6 trang 210 SGK Hóa học 11
Trung hòa 16,60gam hỗn hợp gồm axit axetic và axit fomic bằng dung dịch natri hiđroxit thu được 23,20 gam hỗn hợp hai muối.
a) Viết phương trình hóa học của các phản ứng ở dạng phân tử và ion rút gọn.
b) Xác định thành phần phần trăm khối lượng của mỗi chất trong hỗn hợp trước và sau phản ứng.
Phương pháp giải
a) PTHH dạng phân tử:
CH3COOH + NaOH → CH3COONa + H2O
HCOOH + NaOH → HCOONa + H2O
PTHH dạng ion rút gọn:
CH3COOH + OH- → CH3COO- + H2O
HCOOH + OH- → HCOO- + H2O
b) Đặt x là số mol CH3COOH ; y là số mol HCOOH
CH3COOH + NaOH → CH3COONa + H2O
x → x (mol)
HCOOH + NaOH → HCOONa + H2O
y → y (mol)
Ta có hệ phương trình:
\(\left\{ {\begin{array}{*{20}{l}}
{\sum {{{\mathop{\rm m}\nolimits} _{axit}} = 60x + 46y = 16,6} }\\
{\sum {{m_{muoi}} = 82x + 68y = 23,2} }
\end{array}} \right. \to \left\{ {\begin{array}{*{20}{l}}
{x = ?}\\
{y = ?}
\end{array}} \right.\)
→ Phần trăm khối lượng của các chất trước và sau phản ứng
Hướng dẫn giải
a) PTHH dạng phân tử:
CH3COOH + NaOH → CH3COONa + H2O
HCOOH + NaOH → HCOONa + H2O
PTHH dạng ion rút gọn:
CH3COOH + OH- → CH3COO- + H2O
HCOOH + OH- → HCOO- + H2O
b) Đặt x là số mol CH3COOH ; y là số mol HCOOH
CH3COOH + NaOH → CH3COONa + H2O
x → x (mol)
HCOOH + NaOH → HCOONa + H2O
y → y (mol)
Ta có hệ phương trình:
\(\begin{array}{*{20}{l}}
{\left\{ {\begin{array}{*{20}{l}}
{\sum {{\mathop{\rm m}\nolimits} _{axit}} = 60x + 46y = 16,6}\\
{\sum {m_{muoi}} = 82x + 68y = 23,2}
\end{array}} \right. \to \left\{ {\begin{array}{*{20}{l}}
{x = 0,2(mol)}\\
{y = 0,1(mol)}
\end{array}} \right.}\\
{{m_{C{H_3}COOH}} = 0,2.60 = 12}\\
{ \to \% {m_{C{H_3}COOH}} = \frac{{12}}{{16,6}}.100\% = 72,3\% }\\
{ \to \% {m_{HCOOH}} = 100\% - 72,3\% = 27,7\% }\\
{{m_{C{H_3}COON{\rm{a}}}} = 0,2.82 = 16,4}\\
{ \to \% {m_{C{H_3}COON{\rm{a}}}} = \frac{{16,4}}{{23,2}}.100\% = 70,7\% }\\
{ \to \% {m_{HCOON{\rm{a}}}} = 100\% - 70,7\% = 29,3\% }
\end{array}\)
7. Giải bài 7 trang 210 SGK Hóa học 11
Đun 12,0 gam axit axetic với một lượng dư ancol etylic ( có axit H2SO4 đặc làm xúc tác ). Đến khi dừng thí nghiệm thu được 12,3 gam este.
a) Viết phương trình hóa học của phản ứng.
b) Tính phần trăm khối lượng của axit đã tham gia phản ứng este hóa.
Phương pháp giải
a) PTHH: CH3COOH + C2H5OH ↔ CH3COOC2H5 + H2O
b) Đổi số mol CH3COOC2H5 =?
Tính được nCH3COOH pư = nCH3COOC2H5 =?
↔ %CH3COOH
Hướng dẫn giải
a) nCH3COOH bđ = 12: 60 = 0,2 (mol) ; số mol CH3COOC2H5 = 12,3 : 88 = 0,14 (mol)
PTHH: CH3COOH + C2H5OH ↔ CH3COOC2H5 + H2O
b) nCH3COOH pư = nCH3COOC2H5 = 0,14 (mol)
\(\% C{H_3}COOH = \frac{{0,14}}{{0,2}}.100\% = 70\% \)
