Giải bài tập SGK Hóa 11 Bài 12: Phân bón hóa học
Nội dung hướng dẫn Giải bài tập Hóa 11 Bài 12 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức về phân bón hóa học. Mời các em cùng theo dõi.
Mục lục nội dung

1. Giải bài 1 trang 58 SGK Hóa học 11
Cho các mẫu phân đạm sau đây: amoni sunfat, amoni clorua, natri nitrat. Hãy dùng các thuốc thử thích hợp để phân biệt chúng. Viết phương trình hóa học của các phản ứng đã dùng.
Phương pháp giải
Có thể dùng các thuốc thử: dung dịch kiềm NaOH và dung dịch BaCl2, để nhận biết các chất (NH4)2SO4, NH4Cl, NaNO3.
Hướng dẫn giải
Ta hoà tan một ít các mẫu phân đạm vào nước thì được 3 dung dịch muối: (NH4)2SO4, NH4Cl, NaNO3. Cho từ từ dung dịch Ba(OH)2 vào từng dung dịch:
- Nếu thấy dung dịch nào có khí bay ra có mùi khai và xuất hiện kết tủa trắng là (NH4)2SO4
(NH4)2SO4 + Ba(OH)2 → BaSO4 ↓ + 2NH3 ↑+ 2H2O
- Nếu thấy dung dịch nào có khí bay ra có mùi khai là NH4Cl
2NH4Cl + Ba(OH)2 → BaCl2 + 2NH3 ↑+ 2H2O
- Dung dịch không có hiện tượng gì là NaNO3
2. Giải bài 2 trang 58 SGK Hóa học 11
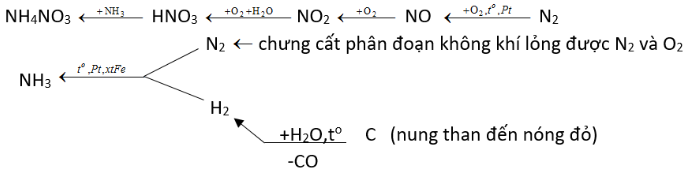
Từ không khí, than, nước và các chất xúc tác cần thiết, hãy lập sơ đồ điều chế phân đạm NH4NO3.
Phương pháp giải
Để điều chế phân đạm NH4NO3 cần phải có NH3 và HNO3. Sau đó từ không khí, than, nước và các chất xúc tác cần thiết ta tìm phương pháp điều NH3 và HNO3.
Hướng dẫn giải
Từ không khí, than, nước, có thể lập sơ đồ điều chế phân đạm NH4NO3 như sau:
Để điều chế phân đạm NH4NO3 cần phải có NH3 và HNO3
3. Giải bài 3 trang 58 SGK Hóa học 11
Một loại quặng photphat có chứa 35% Ca3(PO4)2. Hãy tính hàm lượng phần trăm P2O5 có trong quặng trên.
Phương pháp giải
Để tính hàm lượng phần trăm P2O5 có trong quặng ta lưu ý:
Cứ 1 mol Ca3PO4 ( hay có thể viết 3CaO.P2O5) thì có 1 mol P2O5
Hay 310 gam Ca3PO4 thì có 142 gam P2O5
Vậy 350 gam Ca3PO4 thì có x gam P2O5
=> x =? => phần trăm khối lượng của P2O5 có trong 1000 gam quặng là = ?
Hướng dẫn giải
Trong 1000g quặng có: 1000. 35% = 350g Ca3(PO4)2
Bảo toàn nguyên tố P ⇒ trong 1 mol Ca3(PO4)2 có 1mol P2O5 nghĩa là trong 310g Ca3(PO4)2 tương ứng có 142g P2O5
⇒ 350g Ca3(PO4)2 có lượng P2O5 là:
\({m_{{P_2}{O_5}}} = \frac{{350.142}}{{310}} = 160,3g\)
%P2O5 trong quặng = \(\frac{{160,3.100\% }}{{1000}} = 16,03\% \)
4. Giải bài 4 trang 58 SGK Hóa học 11
Để sản xuất một lượng phân bón amophot đã dùng hết 6,000.103 mol H3PO4.
a) Tính thể tích khí amoniac (đktc) cần dùng, biết rằng loại amophot này có tỉ lệ về số mol nNH4H2PO4: n(NH4)2 HPO4 = 1 : 1.
b) Tính khối lượng amophot thu được.
Phương pháp giải
Viết PTHH xảy ra, tính số mol các muối thu được theo số mol của H3PO4.
2H3PO4 + 3NH3 → (NH4)2 HPO4 + NH4H2PO4
Hướng dẫn giải
Các phương trình hóa học:
H3PO4 + NH3 → NH4H2PO4
H3PO4 + 2NH3 → (NH4)2HPO4
2H3PO4 + 3NH3 → (NH4)2 HPO4 + NH4H2PO4
2 mol 3 mol 1 mol 1 mol
6000 mol 9000 mol 3000 mol 3000 mol
Câu a
Thể tích khí amoniac (đktc) cần dùng:
9000.22,40 = 20,16.104 (lít)
Câu b
Tính khối lượng amophot thu được:
m(NH4)2HPO4 + mNH4H2PO4 = 3000. (132,0 + 115,0) = 7,410 . 105 gam = 741,0 kg
Tham khảo thêm
- doc Giải bài tập SGK Hóa 11 Bài 7: Nitơ
- doc Giải bài tập SGK Hóa 11 Bài 8: Amoniac và muối amoni
- doc Giải bài tập SGK Hóa 11 Bài 9: Axit nitric và muối nitrat
- doc Giải bài tập SGK Hóa 11 Bài 10: Photpho
- doc Giải bài tập SGK Hóa 11 Bài 11: Axit photphoric và muối photphat
- doc Giải bài tập SGK Hóa 11 Bài 13: Luyện tập: Tính chất của nitơ, photpho và hợp chất của chúng
