Giải bài tập SGK Hóa 11 Nâng cao Bài 12: Axit nitric và muối nitrat
Dựa theo nội dung SGK Hóa học 11 nâng cao eLib xin giới thiệu đến các em học sinh bài giải Axit nitric và muối nitrat. Bài này sẽ giúp các em nắm vững được lý thuyết cũng như cách giải các bài tập đầy đủ, chi tiết và rõ ràng. Hy vọng đây sẽ là tài liệu tham khảo hữu ích với các em học sinh.
Mục lục nội dung
1. Giải bài 1 trang 55 SGK Hóa học 11 nâng cao
2. Giải bài 2 trang 55 SGK Hóa học 11 nâng cao
3. Giải bài 3 trang 55 SGK Hóa học 11 nâng cao
4. Giải bài 4 trang 55 SGK Hóa học 11 nâng cao
5. Giải bài 5 trang 55 SGK Hóa học 11 nâng cao
6. Giải bài 6 trang 55 SGK Hóa học 11 nâng cao

1. Giải bài 1 trang 55 SGK Hóa 11 nâng cao
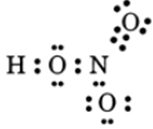
Viết công thức electron và công thức cấu tạo của axit nitric và cho biết nguyên tố có số oxi hóa là bao nhiêu?
Phương pháp giải
Dựa vào cấu hình e ngoài cùng của N, O và H, khả năng cho nhận e để viết công thức electron → Công thức cấu tạo
Hướng dẫn giải
Công thức electron:
Công thức cấu tạo:
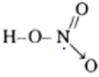
HN+5O3 số oxi hóa của N là +5
2. Giải bài 2 trang 55 SGK Hóa 11 nâng cao
Lập phương trình hóa học của các phản ứng sau đây:
a) Fe + HNO3 (đặc,nóng) → NO2 +⋯
b) Fe + HNO3 (loãng) → NO +⋯
c) Ag + HNO3 (đặc) → NO2 +⋯
d) P + HNO3 (đặc)→ NO2 + H3PO4…
Phương pháp giải
Cần lưu ý một số ý sau đây
- HNO3 đặc sản phẩm khử là NO2
- HNO3 loãng :
+ Kim loại có tính khử TB, yếu (Fe, Cu, Ag,...) sản phẩm khử là NO.
+ Kim loại có tính khử mạnh như (Mg, Al, Zn,…) sản phẩm khử là NO, N2O, N2 , NH4NO3 .
- HNO3 đặc nguội không tác dụng với Al, Fe, Cr
Hướng dẫn giải
Câu a: Fe + 6HNO3 (đặc,nóng) → 3NO2 + Fe(NO3 )3 + 3H2O
Câu b: Fe + 4HNO3 (loãng)→ NO + Fe(NO3 )3 + H2O
Câu c: Ag + 2HNO3 (đặc)→ NO2 + AgNO3 + H2O
Câu d: P + 5HNO3 (đặc) → 5NO2 + H3PO4 + H2O
3. Giải bài 3 trang 55 SGK Hóa 11 nâng cao
Sơ đồ phản ứng sau đây cho thấy rõ vai trò của thiên nhiên và con người trong việc chuyển từ khí quyển vào trong đất, cung cấp nguồn phân đạm cho cây cối.
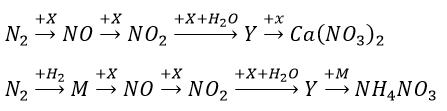
Hãy viết phương trình hóa học của các phản ứng trong sơ đồ chuyển hóa trên.
Phương pháp giải
X là O2; Y là HNO3; Z là CaCO3; M là NH3
Cần nắm vững các tính chất hóa học đặc trưng của các chất có trong sơ đồ
Hướng dẫn giải
X là O2; Y là HNO3; Z là CaCO3; M là NH3
N2 + O2 ⇔ 2NO (đk: 3000oC)
2NO + O2 → 2NO2
4NO2 + O2 + 2H2O → 4HNO3
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
N2 + 3H2 ⇔ 2NH3 (đk: to, xt, p)
4NH3 + 5O2 → 4NO + 6H2O (đk: 850oC, Pt)
HNO3 + NH3 → NH4NO3
4. Giải bài 4 trang 55 SGK Hóa 11 nâng cao
Hợp chất nào sau đây của nitơ không được tạo ra khi cho HNO3 tác dụng với kim loại?
A. NO
B. NH4NO3
C. NO2
D. N2O5
Phương pháp giải
Cần lưu ý một số ý sau đây
- HNO3 đặc sản phẩm khử là NO2
- HNO3 loãng :
+ Kim loại có tính khử TB, yếu (Fe, Cu, Ag,...) sản phẩm khử là NO.
+ Kim loại có tính khử mạnh như (Mg, Al, Zn,…) sản phẩm khử là NO, N2O, N2 , NH4NO3 .
- HNO3 đặc nguội không tác dụng với Al, Fe, Cr
Hướng dẫn giải
N2O5 không được tạo ra khi cho HNO3 tác dụng với kim loại.
→ Đáp án cần chọn là D.
5. Giải bài 5 trang 55 SGK Hóa 11 nâng cao
Tại sao khi điều chế axit nitric bốc khói phải sử dụng H2SO4 đặc và NaNO3 ở dạng rắn?
Phương pháp giải
Nắm vững phương pháp điều chế HNO3
NaNO3 (rắn) + H2SO4 (đặc) → NaHSO4 + HNO3
Hướng dẫn giải
Khi điều chế HNO3 bốc khói (HNO3 tinh khiết) phải sử dụng H2SO4 đặc và NaNO3 ở dạng rắn vì: HNO3 tan nhiều trong nước và tạo thành hỗn hợp đẳng phí (68% HNO3)
NaNO3 (rắn) + H2SO4 (đặc) → NaHSO4 + HNO3
6. Giải bài 6 trang 55 SGK Hóa 11 nâng cao
Phản ứng giữa HNO3 và FeO tạo ra khí NO. tổng các hệ số trong phản ứng oxi hóa – khử này bằng?
A. 22
B. 20
C. 16
D. 12
Phương pháp giải
- Viết phương trình hóa học, cân bằng và tính tổng hệ số
Hướng dẫn giải
Phương trình hóa học trên được hoàn thành như sau:
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
Tổng các hệ số trong phản ứng oxi hóa – khử này bằng 22.
→ Vậy đáp án cần chọn là A.
7. Giải bài 7 trang 55 SGK Hóa 11 nâng cao
Cho 13,5 gam nhôm tác dụng vừa đủ với 2,2 lít dung dịch HNO3 phản ứng tạo ra muối nhôm và một hỗn hợp khí NO và N2O. Tính nồng độ mol của dung dịch HNO3. Biết rằng tỉ khối của hỗn hợp khí đối với hiđro bằng 19,2.
Phương pháp giải
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O (1)
8Al + 10HNO3 → 8Al(NO3)3 + 3N2O + 15H2O (2)
Đặt số mol Al tham gia phản ứng (1) và (2) lần lượt là x mol và y mol.
Ta có: x + y = 13,5 : 27 và \({{M_X}} = \frac{{(30.x + \frac{{44.3y}}{8})}}{{x + \frac{{3y}}{8}}}\)
Hướng dẫn giải
Đặt số mol Al tham gia phản ứng (1) và (2) lần lượt là x mol và y mol.
x + y = 13,5 : 27 (*)
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O (1)
x 4x x
8Al + 10HNO3 → 8Al(NO3)3 + 3N2O + 15H2O (2)
y 15y/4 3y/8
Hỗn hợp khí gồm NO x mol; N2O (3y/8) mol
Theo đề Giải bài ta có: dX/H2 = 19,2
\( \to \overline {{M_X}} = \frac{{(30.x + \frac{{44.3y}}{8})}}{{x + \frac{{3y}}{8}}}\) (**)
Giải hệ (*) và (**) ta được: x = 0,1 và y = 0,4
Từ (1) và (2) → nHNO3 = 4x + 15y/4 = 1,9 mol
Nồng độ mol/lit của dung dịch HNO3 đã dùng: \({C_{{M_{HN{O_3}}}}} = \frac{{1,9}}{{2,2}} = 0,86M\)
8. Giải bài 8 trang 55 SGK Hóa 11 nâng cao
Đốt cháy hoàn toàn 4,4 gam một sunfua kim loại công thức MS (kim loại M có các số oxi hóa +2 và +3 trong các hợp chất) trong lượng dư oxi. Chất rắn thu được sau phản ứng hòa tan trong một lượng vừa đủ dung dịch HNO3 37,8%. Nồng độ phần trăm của muối trong dung dịch thu được là 41,7%.
a) Xác đinh công thức sunfua kim loại.
b) Tính khối lượng dung dịch HNO3 đã dùng.
Phương pháp giải
4MS + 7O2 → 2M2O3 + 4SO2
M2O3 + 6HNO3 → 2M(NO3)3 + 3H2O
Từ PTHH → Khối lượng dung dịch HNO3 đã dùng
→ Khối lượng muối thu được sau phản ứng
mct = mMNO3 = 2(M + 186) → M = ?
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O (2)
Từ (1) và (2) → nHNO3 = ?
→ Khối lượng dung dịch HNO3 37,8% đã dùng ?
Hướng dẫn giải
Câu a: Gọi khối lượng nguyên của M là M
4MS + 7O2 → 2M2O3 + 4SO2
M2O3 + 6HNO3 → 2M(NO3)3 + 3H2O
1 6 2
Xét 1 mol M2O3
Khối lượng dung dịch HNO3 đã dùng:
\({m_{HN{O_3}}} = \frac{{6.63.100}}{{37,8}} = 1000(g)\)
Khối lượng dung dịch thu được sau phản ứng:
mdd = mM2O3 + mddHNO3 = 1.(2M + 48) +1000 = (2M + 1048) (g)
Khối lượng muối thu được sau phản ứng:
mct = mMNO3 = 2(M + 186) (g)
Theo đề Giải bài ta có:
\(C\% = {m_{ct}}.\frac{{1000}}{{{m_{dd}}}} \to 41,7 = \frac{{2(M + 186).100}}{{2M + 1048}}\)
→ M = 56 g/mol (Fe)
Câu b: 4FeS + 7O2 → 2Fe2O3 + 4SO2 (1)
0,05 0,025
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O (2)
0,025 0,15
Từ (1) và (2) → nHNO3 = 0,15 mol
Khối lượng dung dịch HNO3 37,8% đã dùng là
\({m_{dd}} = \frac{{0,15.63.100}}{{37,8}} = 25(g)\)
Tham khảo thêm
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 9: Khái quát về nhóm Nitơ
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 10: Nitơ
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 11: Amoniac và muối amoni
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 13: Luyện tập Tính chất của nitơ và hợp chất của nitơ
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 14: Photpho
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 15: Axit photphoric và muối photphat
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 16: Phân bón hóa học
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 17: Luyện tập Tính chất và các hợp chất của photpho
