Giải bài tập SGK Hóa 11 Nâng cao Bài 47: Stiren và naphtalen
eLib xin giới thiệu tới các bạn bài giải Stiren và naphtalen trang 196 SGK Hóa lớp 11 nâng cao một cách nhanh chóng và hiệu quả, mời các bạn cùng tham khảo chuẩn bị tốt cho bài học sắp tới của mình
Mục lục nội dung

1. Giải bài 1 trang 196 SGK Hóa 11 nâng cao
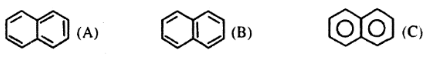
Ba học sinh viết công thức cấu tạo của naphtalen theo ba cách dưới đây và điều cho là mình đúng, bạn sai? Ý kiến của em như thế nào?
Phương pháp giải
Phân tử benzen gồm 6 nguyên tử H và 6 nguyên tử C nằm trong cùng một mặt phẳng trong đó 6 nguyên tử C tạo thành hình lục giác đều, mỗi nguyên tử C lại liên kết với một nguyên tử H nữa. Độ dài các liên kết C-C bằng nhau, độ dài các liên kết C-H cũng như nhau.
Do đó ta xác định được công thức naphtalen
Hướng dẫn giải
Công thức cấu tạo của naphtalen theo 3 cách viết trên đều đúng:
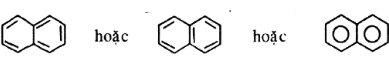
2. Giải bài 2 trang 196 SGK Hóa 11 nâng cao
Hãy viết công thức cấu tạo của các chất sau:
a) o-clostiren, m-nitrostiren; p-flostiren.
b) α-clonaphtalen, β-metylnaphtalen,2-nitronaphatalen,1-flonaphtalen.
Phương pháp giải
Dựa vào công thức stiren và naphtalen để viết công thức của các chất
Hướng dẫn giải
Câu a: Công thức cấu tạo của o-clostiren, m-nitrostiren; p-flostiren
C6H4ClCH=CH2 : o - clostriren
C6H4NO2CH=CH2 : m - nitrostiren
C6H4FCH=CH2 : p - flostiren
Câu b: Công thức cấu tạo của α-clonaphtalen, β-metylnaphtalen,2-nitronaphatalen,1-flonaphtalen
C10H8Cl \(\alpha \) - clonaphtalen
C10H8CH3 \(\beta \) - metyl naphtalen
C10H8NO2 : 2 - nitronaphtalen
C10H8F : 1-flonaphtalen
3. Giải bài 3 trang 196 SGK Hóa 11 nâng cao
Khi cho stiren tác dụng với brom có mặt bột sắt người ta thu được hỗn hợp 3 chất có công thức phân tử C8H7Br3. Hãy viết công thức cấu tạo của chúng và cho biết đã xảy ra các phản ứng nào?
Phương pháp giải
Phân tử stiren được cấu tạo từ 2 phần: vòng benzen và nhánh vinyl (nhóm thế loại II) → tính chất hóa học của stiren được biểu hiện cả ở vòng benzen và nhánh
Hướng dẫn giải
Các phương trình hóa học khi cho stiren tác dụng với brom có mặt bột sắt:
.png)
.png)
Vậy các phản ứng đã xảy ra là phản ứng cộng và phản ứng thế.
4. Giải bài 4 trang 196 SGK Hóa 11 nâng cao
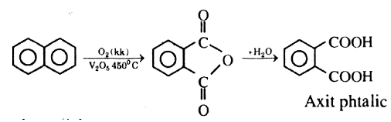
Axit phtalic: C8H6O4 dùng nhiều trong sản xuất chất dẻo và dược phẩm được điều chế như sau: Oxi hóa naphtalen bằng O2 với xúc tác V2O5 ở 450oC rồi cho sản phẩm tác dụng với nước. Hãy dùng công thức viết sơ đồ phản ứng.
Phương pháp giải
Để giải bài tập này cần nắm rõ tính chất, khả năng phản ứng của naphtalen
Hướng dẫn giải
Sơ đồ điều chế axit phtalic:
5. Giải bài 5 trang 196 SGK Hóa 11 nâng cao
Chỉ dùng một thuốc thử, hãy phân biệt các chất trong các nhóm sau, viết sơ đồ phản ứng xảy ra:
a) Bezen, etyl benzene và stiren.
b) Stiren, phenylaxetilen.
Phương pháp giải
Phân biệt bezen, etyl benzene và stiren → Dùng dung dịch KMnO4
Phân biệt stiren, phenylaxetilen → Dùng dung dịch AgNO3/NH3
Hướng dẫn giải
Câu a: Phân biệt bezen, etyl benzene và stiren
Dùng dung dịch KMnO4:
Stiren làm mất màu KMnO4, ở nhiệt độ thường:
3C6H5-CH=CH2 + 2KMnO4 + 4H2O → 3C6H5-CH(OH)-CH2(OH) + 2KOH + 2MnO2
Etyl benzen làm mất màu KMnO4 khi đun nóng:
C6H5-C2H5 → C6H5-COOK
Còn lại là benzen.
Câu b: Phân biệt stiren, phenylaxetilen
Dùng dung dịch AgNO3/NH3 nhận biết được phenylaxetilen vì tạo ra kết tủa vàng nhạt:
C6H5-C≡CH + [Ag(NH3)2](OH) → C6H5-C≡CAg + 2NH3 + H2O
Còn lại là stiren.
6. Giải bài 6 trang 196 SGK Hóa 11 nâng cao
Trong công nghiệp, để điều chế stiren người ta làm như sau: Cho etilen phản ứng với benzene có xúc tác axit thu được etyl benzene rồi cho etyl benzene qua xúc tác ZnO nung nóng.
a) Hãy viết phương trình hóa học của phản ứng xảy ra.
b) Hãy tính xem 1 tấn benzen cần tối thiểu bao nhiêu m3 etilen và tạo thành bao nhiêu kg stiren, biết rằng hiệu suất mỗi giai đoạn phản ứng đều đạt 80%.
Phương pháp giải
- Viết PTHH của phản ứng
- Tính toán theo phương trình
Hướng dẫn giải
Câu a: Các phương trình hóa học của phản ứng:
C6H6 + CH2=CH2 → C6H5CH2CH3 (1)
C6H5CH2CH3 → C6H5-CH=CH2 + H2 (2)
Câu b: Từ (1) ta có:
nC2H4 = nC6H6 = 106 / 78 = 12820,51 mol
Sơ đồ hợp thức:
C6H6 → C2H4 → C8H8
78g 22,4 lít 104g
1000kg x y
Thể tích C2H4 cần dùng ở điều kiện tiêu chuẩn:
VC2H4 = \(x = \frac{{{{10}^6}.22,4}}{{78}} = 287,18{m^3}\)
Khối lượng C8H8 thực tế thu được là:
mC8H8 = \(y = \frac{{{{10}^6}.104}}{{78}}.\frac{{80}}{{100}}.\frac{{80}}{{100}} = 853,33kg\)
