Giải bài tập SGK Hóa 11 Nâng cao Bài 6: Phản ứng trao đổi ion trong dung dịch các chất điện li
Dưới đây là Hướng dẫn giải Hóa 11 SGK nâng cao Chương 1 Bài 6 Phản ứng trao đổi ion trong dung dịch các chất điện li được eLib biên soạn và tổng hợp, nội dung bám sát theo chương trình SGK Hóa học 11 nâng cao giúp các em học sinh nắm vững phương pháp giải bài tập và ôn tập kiến thức hiệu quả hơn.
Mục lục nội dung
1. Giải bài 1 trang 28 SGK Hóa học 11 nâng cao
2. Giải bài 2 trang 28 SGK Hóa học 11 nâng cao
3. Giải bài 3 trang 29 SGK Hóa học 11 nâng cao
4. Giải bài 4 trang 29 SGK Hóa học 11 nâng cao
5. Giải bài 5 trang 29 SGK Hóa học 11 nâng cao
6. Giải bài 6 trang 29 SGK Hóa học 11 nâng cao
7. Giải bài 7 trang 29 SGK Hóa học 11 nâng cao
8. Giải bài 8 trang 29 SGK Hóa học 11 nâng cao
9. Giải bài 9 trang 29 SGK Hóa học 11 nâng cao

1. Giải bài 1 trang 28 SGK Hóa 11 nâng cao
Điều kiện để xảy ra phản ứng trao đổi ion trong dung dịch các chất điện li là gì? Lấy các thí dụ minh họa.
Phương pháp giải
Điều kiện để xảy ra phản ứng trao đổi ion:
+ Chất tham gia phản ứng phải tan
+ Có sự tạo thành kết tủa, chất bay hơi, chất điện li yếu
Hướng dẫn giải
Điều kiện để xảy ra phản ứng trao đổi ion:
Chất tham gia phản ứng phải tan ( trừ phản ứng với axit)
Có sự tạo thành:
- Chất kết tủa (chất ít tan hơn, chất không tan)
- Chất dễ bay hơi
- Chất điện li yếu hơn.
Ví dụ:
+ Sản phẩm là chất kết tủa
Phương trình dưới dạng phân tử:
Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl
Phương trình ion rút gọn:
Ba2+ + SO42- → BaSO4↓
+ Sản phẩm là chất điện li yếu
Phương trình dưới dạng phân tử:
2HCl + Na2CO3 → 2NaCl + H2O + CO2
Phương trình ion rút gọn:
2H+ + CO32- → CO2↑ + H2O
2. Giải bài 2 trang 28 SGK Hóa 11 nâng cao
Viết phương trình ion rút gọn của các phản ứng (nếu có) xảy ra trong dung dịch giữa các cặp chất sau:
a) Fe2(SO4)3 + NaOH
b) KNO3 + NaCl
c) NaHSO3 + NaOH
d) Na2HPO4 + HCl
e) Cu(OH)2 (r) + HCl
g) FeS (r) + HCl
h) Cu(OH)2 (r) + NaOH (đặc)
i) Sn(OH)2 (r) + H2SO4
Phương pháp giải
Nắm vững kĩ năng viết phương trình ion thu gọn của các phản ứng
Hướng dẫn giải
Câu a: Fe2(SO4)3 + 6NaOH → 2Fe(OH)3↓ + 3Na2SO4 ( Fe3+ + 3OH- → Fe(OH)3↓)
Câu b: KNO3 + NaCl: không phản ứng
Câu c: NaHSO3 + NaOH → Na2SO3 + H2O (HSO3- + OH- → SO32- + H2O)
Câu d: Na2HPO4 + 2HCl → 2NaCl + H3PO4 ( HPO42- + 2H+ ↔ H3PO4)
Câu e: Cu(OH)2 + 2HCl → CuCl2 + 2H2O (Cu(OH)2 + 2H+ → Cu2+ + 2H2O)
Câu f: FeS + 2HCl → FeCl2 + H2S↑ (FeS + 2H+ → Fe2+ + H2S↑)
Câu h: Cu(OH)2r + NaOH: không phản ứng.
Câu i: Sn(OH)2 + H2SO4 → SnSO4 + 2H2O (Sn(OH)2 + 2H+ → Sn2+ + 2H2O)
3. Giải bài 3 trang 29 SGK Hóa 11 nâng cao
Hãy điều chế kết tủa CuS bằng ba phản ứng trao đổi ion khác nhau xảy ra trong dung dịch. Từ đó rút ra bản chất của phản ứng trong các dung dịch này.
Phương pháp giải
Bản chất của các phản ứng này là phản ứng trao đổi ion: Cu2+ + S2- → CuS↓
Hướng dẫn giải
Cu(NO3)2 + Na2S → CuS↓ + 2NaNO3
CuSO4 + H2S → CuS↓ + H2SO4
CuCl2 + K2S → CuS↓ + 2KCl
Bản chất của các phản ứng này là phản ứng trao đổi ion: Cu2+ + S2- → CuS↓
4. Giải bài 4 trang 29 SGK Hóa 11 nâng cao
Phương trình ion rút gọn của phản ứng cho biết
A. những ion nào tồn tại trong dung dịch.
B. nồng độ những ion nào trong dung dịch lớn nhất.
C. bản chất của bản ứng trong dung dịch các chất điện li.
D. không tồn tại các phân tử trong dung dịch các chất điện li.
Phương pháp giải
Phương trình ion rút gọn của phản ứng cho biết bản chất của bản ứng
Hướng dẫn giải
Phương trình ion rút gọn của phản ứng cho biết bản chất của bản ứng trong dung dịch các chất điện li.
→ Đáp án C.
5. Giải bài 5 trang 29 SGK Hóa 11 nâng cao
a) Dùng phản ứng hóa học để tách cation Ca2+ ra khỏi dung dịch chưa NaNO3 và Ca(NO3)2.
b) Dùng phản ứng hóa học để tách anion Br- ra khỏi dung dịch chứa KBr và KNO3.
Phương pháp giải
a) Ca2+ + CO32- → CaCO3↓
CaCO3 + 2H+ → Ca2+ + CO2↑ + H2O
b) Ag+ + Br- → AgBr↓
2AgBr (as) → 2Ag + Br2
2Na + Br2 → 2NaBr
Hướng dẫn giải
Khác với nhận biết tách chất phải có bước tái tạo (hoàn trả lại sản phẩm ban đầu và thông thường phải đảm bảo khối lượng không đổi của các chất trước và sau khi tách).
Câu a: Tách Ca2+ khỏi dung dịch có chứa Na+, Ca2+.
Cho dung dịch tác dụng với một lượng dư dung dịch Na2CO3 lọc thu kết tủa.
Ca2+ + CO32- → CaCO3↓
Hòa tan kết tủa trong dung dịch HNO3 thu được Ca2+
CaCO3 + 2H+ → Ca2+ + CO2↑ + H2O
Câu b: Tách Br- khỏi dung dịch có chứa Br-, NO3-.
Cho dung dịch tác dụng với một lượng dư dung dịch AgNO3, lọc thu kết tủa.
Ag+ + Br- → AgBr↓
Phân hủy AgBr ngoài ánh sáng, thu Br2. Cho Br2 tác dụng với Na thu được Br-.
2AgBr (as)→ 2Ag + Br2
2Na + Br2 → 2NaBr
6. Giải bài 6 trang 29 SGK Hóa 11 nâng cao
Một trong các nguyên nhân gây bệnh đau dạ dày là do lượng axit HCl trong dạ dày quá cao. Để giảm bớt lượng axit, người ta thường uống dược phẩm Nabica (NaHCO3). Viết phương trình ion rút gọn của phản ứng xảy ra.
Phương pháp giải
Khi đó Nabica sẽ tác dụng với HCl có trong axit dạ dày
Hướng dẫn giải
Phương trình dưới dạng phân tử:
NaHCO3 + HCl → NaCl + CO2↑ + H2O
Phương trình ion rút gọn:
HCO3- + H+ → CO2↑ + H2O
7. Giải bài 7 trang 29 SGK Hóa 11 nâng cao
Khi nhúng cặp điện cực vào cốc đựng dung dịch H2SO4 trong bộ dụng cụ như ở hình 1.1 rồi nối các dây dẫn điện với nguồn điện, bóng đèn sáng rõ. Sau khi thêm vào cốc đó một lượng dung dịch Ba(OH)2, bóng đèn sáng yếu đi. Nếu cho dư dung dịch Ba(OH)2 vào, bóng đèn lại sáng rõ. Giải thích.
Phương pháp giải
- H2SO4 là chất điện li mạnh vì vậy bóng đèn sáng.
- Khi cho dung dịch Ba(OH)2 vào ồng độ SO42- và H+ giảm đi do tạo thành chất khó tan BaSO4 và chất kém điện li H2O, nên bóng đèn sáng yếu đi.
- Khi dư dung dịch Ba(OH)2 nồng độ các ion trong dung dịch tăng (Ba(OH)2 là chất điện li mạnh) bóng đèn sáng trở lại.
Hướng dẫn giải
- H2SO4 là chất điện li mạnh vì vậy bóng đèn sáng.
H2SO4 → 2H+ + SO42-
- Khi cho dung dịch Ba(OH)2 vào xảy ra phản ứng
H2SO4 + Ba(OH)2 → BaSO4↓ + 2H2O
Nồng độ SO42- và H+ giảm đi do tạo thành chất khó tan BaSO4 và chất kém điện li H2O, nên bóng đèn sáng yếu đi.
- Khi dư dung dịch Ba(OH)2 nồng độ các ion trong dung dịch tăng (Ba(OH)2 là chất điện li mạnh) bóng đèn sáng trở lại.
Ba(OH)2 → Ba2+ + 2OH-
8. Giải bài 8 trang 29 SGK Hóa 11 nâng cao
Viết phương trình hóa học dưới dạng phân tử và ion rút gọn của phản ứng trao đổi ion trong dung dịch tạo thành từng kết tủa sau (hình 1.9):
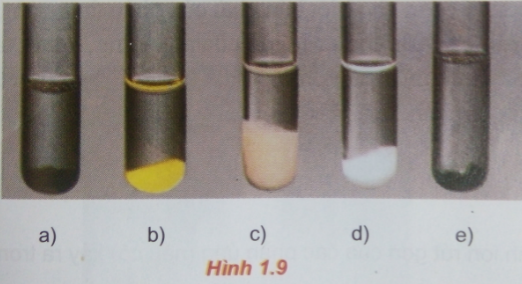
a) CuS
b) CdS
c) MnS
d) ZnS
e) FeS
Phương pháp giải
Nắm vững kĩ năng viết phương trình ion thu gọn của các phản ứng
Hướng dẫn giải
Câu a: CuSO4 + Na2S → CuS↓ + Na2SO4 ( Cu2+ + S2- → CuS↓)
Câu b: CdSO4 + Na2S → CdS↓ + Na2SO4 ( Cd2+ + S2- → CdS↓)
Câu c: MnSO4 + Na2S → MnS↓ + Na2SO4 ( Mn2+ + S2- → MnS↓)
Câu d: ZnSO4 + Na2S → ZnS↓ + Na2SO4 ( Zn2+ + S2- → ZnS↓)
Câu e: FeSO4 + Na2S → FeS↓ + Na2SO4 ( Fe2+ + S2- → FeS↓)
9. Giải bài 9 trang 29 SGK Hóa 11 nâng cao
Dung dịch chất nào dưới đây có môi trường kiềm?
A. AgNO3
B. NaClO3
C. K2CO3
D. SnCl2.
Phương pháp giải
Viết phương trình ion, phương trình nào phân li ra OH- là môi trường kiềm
Hướng dẫn giải
Chọn C. K2CO3:
K2CO3 → 2K+ + CO32-
CO32- + H2O ↔ HCO3- + OH-
10. Giải bài 10 trang 29 SGK Hóa 11 nâng cao
Dung dịch chất nào dưới đây có môi trường axit?
A. NaNO3
B. KClO4
C. Na3PO4
D. NH4Cl
Phương pháp giải
Viết phương trình ion, phương trình nào phân li ra H3O+ là môi trường axit
Hướng dẫn giải
Chọn D. NH4Cl
NH4Cl → NH4+ + Cl-
NH4+ + H2O ↔ NH3 + H3O+
11. Giải bài 11 trang 29 SGK Hóa 11 nâng cao
Tính nồng độ H+ (mol/l) trong các dung dịch sau:
a) CH3COONa 0,10M (Kb của CH3COO- là 5,71.10-10);
b) NH4Cl 0,10M (Ka của NH4+ là 5,56.10-10).
Phương pháp giải
a) CH3COO- + H2O ⇔ CH3COOH + OH-
\(\begin{array}{l}
{K_a} = \frac{{[C{H_3}COOH][O{H^ - }]}}{{[C{H_3}CO{O^ - }]}} = 5,{71.10^{ - 10}}\\
\to \frac{{x.x}}{{(0,1 - x)}} = 5,{71.10^{ - 10}}
\end{array}\)
→ x = ? ⇒ [OH-] = ? → [H+] = ?
b) NH4+ + H2O ⇔ NH3 + H3O
\(\begin{array}{l}
{K_a} = \frac{{[N{H_3}].[{H_3}{O^ + }]}}{{[NH_4^ + ]}} = 5,{56.10^{ - 10}}\\
\to \frac{{x.x}}{{(0,1 - x)}} = 5,{56.10^{ - 10}}
\end{array}\)
→ x = ? ⇒ [H3O+] = ?
Hướng dẫn giải
Câu a:
CH3COO- + H2O ⇔ CH3COOH + OH-
Trước thủy phân: 0,1
Thủy phân: x x
Sau thủy phân: (0,1-x) x
Ta có:
\(\begin{array}{l}
{K_a} = \frac{{[C{H_3}COOH][O{H^ - }]}}{{[C{H_3}CO{O^ - }]}} = 5,{71.10^{ - 10}}\\
\to \frac{{x.x}}{{(0,1 - x)}} = 5,{71.10^{ - 10}}
\end{array}\)
Vì x << 0,1 ⇒ (0,1 – x) ≈ 0,1
⇒ x.x = 0,1.5,71.10-10 = 0,571.10-10
⇒ x = 0,76.10-5.
⇒ [OH-] = 0,76.10-5 mol/lít
Ta có: [OH-].[H+] = 10-14 ⇒ \([{H^ + }] = \frac{{{{10}^{ - 14}}}}{{0,{{76.10}^{ - 5}}}} = 1,{3.10^{ - 9}}mol/lit\)
Câu b: NH4+ + H2O ⇔ NH3 + H3O
Trước thủy phân: 0,1
Thủy phân: x x x
Sau thủy phân: (0,1-x) x x
Ta có:
\(\begin{array}{l}
{K_a} = \frac{{[N{H_3}].[{H_3}{O^ + }]}}{{[NH_4^ + ]}} = 5,{56.10^{ - 10}}\\
\to \frac{{x.x}}{{(0,1 - x)}} = 5,{56.10^{ - 10}}
\end{array}\)
Vì x << 0,1 ⇒ (0,1 – x) ≈ 0,1
⇒ x.x = 0,1.5,56.10-10 = 0,556.10-10
⇒ x = 0,75.10-5.
⇒ [H3O+] = 0,75.10-5 mol/lít.
Tham khảo thêm
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 1: Sự điện li
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 2: Phân loại các chất điện li
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 3: Axit, bazơ và muối
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 4: Sự điện li của nước - pH - Chất chỉ thị axit bazo
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 5: Luyện tập Axit, bazơ và muối
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 7: Luyện tập Phản ứng trao đổi ion trong dung dịch chất điện li
