Giải bài tập SGK Hóa 11 Nâng cao Bài 61: TCHH, điều chế và ứng dụng Axit cacboxylic
Dưới đây là Hướng dẫn giải Hóa 11 SGK nâng cao Chương 9 Bài 61 Axit cacboxylic - Tính chất hóa học, điều chế và ứng dụng được eLib biên soạn và tổng hợp, nội dung bám sát theo chương trình SGK Hóa học 11 nâng cao giúp các em học sinh nắm vững phương pháp giải bài tập và ôn tập kiến thức hiệu quả hơn.
Mục lục nội dung
1. Giải bài 1 trang 256 SGK Hóa học 11 nâng cao
2. Giải bài 2 trang 256 SGK Hóa học 11 nâng cao
3. Giải bài 3 trang 256 SGK Hóa học 11 nâng cao
4. Giải bài 4 trang 256 SGK Hóa học 11 nâng cao
5. Giải bài 5 trang 257 SGK Hóa học 11 nâng cao
6. Giải bài 6 trang 257 SGK Hóa học 11 nâng cao
7. Giải bài 7 trang 257 SGK Hóa học 11 nâng cao

1. Giải bài 1 trang 256 SGK Hóa 11 nâng cao
Viết phương trình hoá học của các phản ứng để minh hoạ:
a) Axit axetic có đầy đủ tính chất của một axit.
b) Axit axetic là một axit yếu nhưng vẫn mạnh hơn axit cacbonic, còn phenol là một axit yếu hơn axit cacbonic.
Phương pháp giải
Dựa vào tính chất hóa học của axit axetic để viết các phương trình phản ứng minh họa
+ Dung dịch axit cacboxylic làm quỳ tím chuyển sang màu đỏ.
+ Tác dụng với bazơ, oxit bazơ tạo thành muối và nước
+ Tác dụng với muối
+ Tác dụng với kim loại trước hiđro
Hướng dẫn giải
Câu a: CH3COOH có tính chất đầy đủ của một axit.
CH3COOH + H2O ⇔ CH3COO- + H3O+. Làm quỳ tím hóa đỏ.
2CH3COOH + 2Na → 2CH3COONa + H2
CH3COOH + NaOH → CH3COONa + H2O
2CH3-COOH + CaO → (CH3COO)2Ca + H2O
2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O
Câu b:
2CH3-COOH + Na2CO3 → 2CH3-COONa + CO2 + H2O
C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3
2. Giải bài 2 trang 256 SGK Hóa 11 nâng cao
Hãy điền chữ Đ (đúng) hoặc chữ S (sai) vào các dấu [... ] ở mỗi câu sau:
a) Giấm ăn làm đỏ quỳ tím. [... ]
b) Nước ép từ quả chanh không hoà tan được CaCO3. [ ...]
c) Dùng axit axetic tẩy sạch được cặn bám ở trong phích nước nóng. [ ...]
d) Phản ứng của axit axetic với etanol là phản ứng trung hoà. [ ...]
Phương pháp giải
Dựa vào tính chất vật lí, hóa học của axit cacboxylic, phân tích từng nhận định và đưa ra kết luận
Hướng dẫn giải
a) Đ
b) S
c) Đ
d) S
3. Giải bài 3 trang 256 SGK Hóa 11 nâng cao
Hãy sắp xếp các axit trong các dãy sau theo thứ tự tăng dần lực axit:
a) CH3 COOH,Cl3CCOOH,Cl2CHCOOH,ClCH2COOH
b) ClCH2CH2COOH,CH3 CH(Cl)CH2COOH,CH3 CH2CH(Cl)COOH,CH3CH2CH2COOH
Phương pháp giải
Học sinh xem phần kiến thức bổ sung chương IX.
+ Nếu gốc R no (đẩy e) làm giảm tính axit. Gốc R no càng nhiều nguyên tử C thì khả năng đẩy e càng mạnh: HCOOH > CH3COOH > CH3CH2COOH > CH3CH2CH2COOH > n-C4H9COOH.
+ Nếu gốc R hút e (không no, thơm hoặc có halogen...) sẽ làm tăng tính axit.
* Xét với gốc R có chứa nguyên tử halogen:
+ Halogen có độ âm điện càng lớn thì tính axit càng mạnh:
CH2FCOOH > CH2ClCOOH > CH2BrCOOH > CH2ICOOH > CH3COOH
+ Gốc R có chứa càng nhiều nguyên tử halogen thì tính axit càng mạnh:
Cl3CCOOH > Cl2CHCOOH > ClCH2COOH > CH3COOH
+ Nguyên tử halogen càng nằm gần nhóm COOH thì tính axit càng mạnh:
CH3CH2CHClCOOH > CH3CHClCH2COOH > CH2ClCH2CH2COOH > CH3CH2CH2COOH
- Với một cặp axit/bazơ liên hợp: tính axit càng mạnh thì bazơ liên hợp của nó càng yếu và ngược lại.
- Với một phản ứng: axit mạnh đẩy được axit yếu khỏi dung dịch muối (trường hợp trừ một số đặc biệt).
Hướng dẫn giải
Lực axit theo thứ tự tăng dần trái từ qua phải.
Câu a: CH3COOH < ClCH2-COOH < Cl2CH-COOH < Cl3C-COOH
Câu b: CH3(CH2)2COOH < Cl(CH2)3COOH < CH3CHClCOOH < CH3CH2CHClCOOH
4. Giải bài 4 trang 256 SGK Hóa 11 nâng cao
Hai bình như nhau, bình A chứa 0,50 lít axit clohiđric 2M, bình B chứa 0,50 lít axit axetic 2,0M được bịt kín bởi 2 bóng cao su như nhau. Hai mẩu Mg khối lượng như nhau được thả xuống cùng một lúc. Kết quả sau 1 phút và sau 10 phút (phản ứng đã kết thúc) được thể hiện như ở hình dưới đây. Hãy nhận xét và giải thích.

Phương pháp giải
Quan sát hiện tượng, viết PTHH của phản ứng tính toán số mol nCH3COOH và HCl thoát ra → nhận xét, giải thích
Hướng dẫn giải
Mg + 2HCl → MgCl2 + H2
Mg + 2CH3COOH → (CH3COO)2Mg + H2
nCH3COOH = nHCl = 0,5.2 = 1 mol
HCl là chất điện li mạnh nên phân li hoàn toàn ⇒ nồng độ H+ lớn ⇒ H2 thoát ra mạnh hơn. CH3COOH là chất điện li yếu ⇒ nồng độ H+ nhỏ ⇒ H2 thoát ra yếu hơn.
Sau 1 phút thấy khí H2 ở HCl nhiều hơn so với CH3COOH (Mg phản ứng với HCl nhanh hơn CH3COOH). Sau phản ứng kết thúc 10 phút khí H2 bay ra ở 2 bình như nhau vì nH2 = 0,5 mol (bằng nhau).
5. Giải bài 5 trang 257 SGK Hóa 11 nâng cao
Viết phương trình hoá học của phản ứng khi cho axit acrylic tác dụng lần lượt với các chất sau:
a) C6H5ONa
b) NaHCO3
c) H2 (Ni,to)
d) Br2/CCl4
e) P2O5
g) Trùng hợp
Phương pháp giải
Dựa vào tính chất hóa học của axit CH2=CH-COOH để viết các phương trình phản ứng
Hướng dẫn giải
Câu a: CH2=CH-COOH + C6H5ONa → CH2=CH-COONa + C6H5OH
Câu b: CH2=CH-COOH + NaHCO3 → CH2=CH-COONa + CO2 + H2O
Câu c: CH2=CH-COOH + H2 → CH3-CH2-COOH (xt: Ni, to)
Câu d: CH2=CH-COOH + Br2 → CH2Br- CHBr-COOH (xt: CCl4)
Câu e: CH2=CH-COOH → (CH2=CH-CO)2O + H2O (xt: P2O5)
6. Giải bài 6 trang 257 SGK Hóa 11 nâng cao
Hoàn thành các sơ đồ phản ứng sau (các chữ cái chỉ sản phẩm hữu cơ chính):
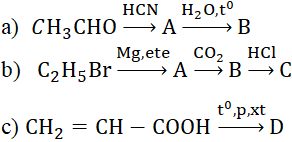
Phương pháp giải
Dựa vào tính chất hóa học của axit, ancol, andehit ... để viết các phương trình phản ứng
Hướng dẫn giải
Câu a: CH3CHO + HCN → CH3CH(CN)OH
CH3CH(CN)OH + 2H2O → CH3CH(OH)COOH + NH3
Câu b: CH3CH2Br + Mg → CH3CH2-Mg-Br
CH3CH2-Mg-Br + CO2 → CH3CH2COO-Mg-Br
CH3CH2COO-Mg-Br + HCl → CH3CH2COOH + MgClBr
Câu c:
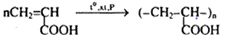
7. Giải bài 7 trang 257 SGK Hóa 11 nâng cao
Hãy phân biệt các chất trong các nhóm sau:
a) Etanol, fomalin, axeton, axit axetic.
b) Phenol, p – nitrobenzanđehit, axit benzoic.
Phương pháp giải
a) Dùng quỳ tím, AgNO3/NH3 và Na
b) Dùng quỳ tím và AgNO3/NH3
Hướng dẫn giải
Câu a: Dùng quỳ tím nhận biết được axit axetic vì quỳ tím hóa đỏ.
Dùng phản ứng tráng gương nhận biết được fomalin vì tạo kết tủa Ag.
HCHO + 4[Ag(NH3)2](OH) → (NH4)2CO3 + 4Ag + 6NH3 + 2H2O
Dùng Na nhận biết được C2H5OH vì sủi bọt khí H2. Mẫu còn lại là axeton.
Câu b: Dùng quỳ tím nhận biết được axit bezoic vì làm quỳ tím hóa đỏ.
Dùng phản ứng tráng gương nhận biết được p – nitrobenzenđehit vì tạo ra kết tủa Ag. Mẫu còn lại là phenol.
p-NO2-C4H6CHO + 2[Ag(NH3)2]OH → P-NO2-C4H6COONH4 + 2Ag + 3NH3 + H2O
8. Giải bài 8 trang 257 SGK Hóa 11 nâng cao
Để trung hoà 40,0ml giấm cần dùng 25,0ml dung dịch NaOH 1,00M. Coi khối lượng riêng của giấm không khác khối lượng riêng của nước. Hãy tính nồng độ % của axit axetic trong mẫu giấm nói trên.
Phương pháp giải
Tính theo phương trình hóa học
nNaOH → nCH3COOH → mCH3COOH
→ %C = ?
Hướng dẫn giải
nNaOH = 0,025 .1 = 0,025 mol
CH3COOH + NaOH → CH3COONa + H2O
nCH3COOH = nNaOH = 0,025 mol
mCH3COOH = 0,025. 60 = 1,5 g
mdd CH3COOH = D.V = 1.40 = 40 g
\(C\% (C{H_3}COOH) = \frac{{1,5}}{{40}}.100\% = 3,75\% \)
9. Giải bài 9 trang 257 SGK Hóa 11 nâng cao
Thêm nước vào 10 ml axit axetic bằng (axit 100%, D = 1,05 g/cm3) đến thể tích 1,75 lít ở 25oC rồi dùng máy đo thì thấy pH = 2,9.
a) Tính nồng độ mol của dung dịch thu được.
b) Tính độ điện li α của axit axetic ở dung dịch nói trên.
c) Tính gần đúng hằng số cân bằng của axit axetic ở 25oC.
Phương pháp giải
a) Áp dụng công thức \(n = \frac{{C\% .D.V}}{{100.M}}\) → CM = ?
b) pH=2,9 ⇒ [H+]=10-2,9 M
Viết phương trình điện li → \(\alpha \) = ?
c) \({K_a} = \frac{{[C{H_3}CO{O^ - }][{H^ + }]}}{{[C{H_3}COOH]}} = \frac{{0,1\alpha .0,1\alpha }}{{0,1.(1 - \alpha )}}\)
→ Ka = ?
Hướng dẫn giải
Câu a: Số mol CH3COOH:
\(n = \frac{{C\% .D.V}}{{100.M}} = 0,175mol\)
Nồng độ mol/lit của CH3COOH trong dung dịch: CM = 0,175/1,75 = 0,1 M
Câu b: pH=2,9 ⇒ [H+]=10-2,9 M
CH3COOH ⇔ CH3COO- + H+
Trước điện li 0,1 0 0
Điện li 0,1\(\alpha \) 0,1\(\alpha \) 0,1\(\alpha \)
Sau điện li (0,1 - 0,1\(\alpha \) ) 0,1\(\alpha \) 0,1\(\alpha \)
Ta có: 0,1\(\alpha \) = 10-2,9 ⇔ \(\alpha \) = 10-1,9 = 0,0126
Câu c: \({K_a} = \frac{{[C{H_3}CO{O^ - }][{H^ + }]}}{{[C{H_3}COOH]}} = \frac{{0,1\alpha .0,1\alpha }}{{0,1.(1 - \alpha )}}\)
Vì \(\alpha \) << 1 ⇒ 0,1.(1- \(\alpha \)) = 0,1
\( \to {K_a} = 0,1.{\alpha ^2} = 0,{1.10^{ - 3,8}} = {10^{ - 4,8}} = 1,{58.10^{ - 5}}\)
Tham khảo thêm
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 58: Anđehit và xeton
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 59: Luyện tập Anđehit và xeton
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 60: Cấu trúc, danh pháp, tính chất vật lí Axit cacboxylic
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 62: Luyện tập Axit cacboxylic
