Giải bài tập SGK Hóa 11 Nâng cao Bài 51: Dẫn xuất halogen của hiđrocacbon
eLib giới thiệu đến các em học sinh tài liệu Giải bài tập Dẫn xuất halogen của hiđrocacbon môn Hóa 11. Tài liệu hướng dẫn trả lời các câu hỏi trong SGK lớp 11 nâng cao môn Hóa. Mời các em tham khảo chuẩn bị tốt cho bài học sắp tới
Mục lục nội dung
1. Giải bài 1 trang 215 SGK Hóa học 11 nâng cao
2. Giải bài 2 trang 215 SGK Hóa học 11 nâng cao
3. Giải bài 3 trang 215 SGK Hóa học 11 nâng cao
4. Giải bài 4 trang 216 SGK Hóa học 11 nâng cao
5. Giải bài 5 trang 216 SGK Hóa học 11 nâng cao
6. Giải bài 6 trang 216 SGK Hóa học 11 nâng cao

1. Giải bài 1 trang 215 SGK Hóa 11 nâng cao
Gọi tên các dẫn xuất halogen sau theo hai cách và chỉ rõ bậc của chúng:
a) CH3I, CHI3, BrCH2CH2CH2CH2Br, CH3CHFCH3, (CH3)2CClCH2CH3
b) CH2=CHCH2Br, C6H5CH2I, p-FC6H4CH3, o-ClC6H4CH2CH3, m-F2C6H4
Phương pháp giải
- Bậc của dẫn xuất halogen chính là bậc của nguyên tử C liên kết trực tiếp với nguyên tử halogen.
Hướng dẫn giải
Câu a:
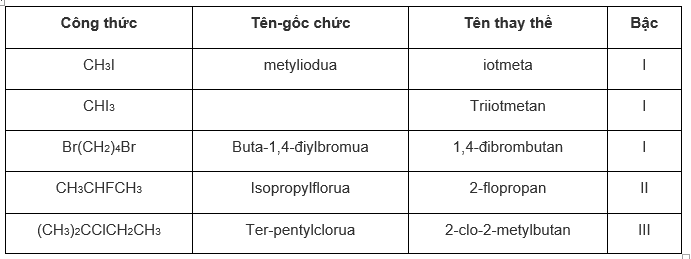
CHI3 có tên thông thường là Iođofom
Câu b:

2. Giải bài 2 trang 215 SGK Hóa 11 nâng cao
Hãy viết công thức cấu trúc (công thức lập thể) và gọi tên các đồng phân ứng với công thức phân tử:
a) C2H2CIF
b) C3H5Cl
Phương pháp giải
Dẫn xuất halogen có đồng phân mạch cacbon và đồng phân vị trí nhóm chức.
Hướng dẫn giải
Công thức lập thể và tên của đồng phân C2H2CIF:
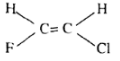 cis - clo - 2 - florten
cis - clo - 2 - florten
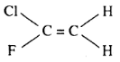
 trans - clo - 2 - floeten
trans - clo - 2 - floeten
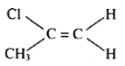
 1 - clo - 2 - floeten
1 - clo - 2 - floeten
Câu b
Công thức lập thể và tên của đồng phân C3H5Cl:
 cis - 1 - clopropen
cis - 1 - clopropen
 trans - 1 - clopropen
trans - 1 - clopropen
 2 - clopropen
2 - clopropen
3. Giải bài 3 trang 215 SGK Hóa 11 nâng cao
Nhiệt độ sôi (độ C) của một số dẫn xuất halogen cho trong bảng sau:
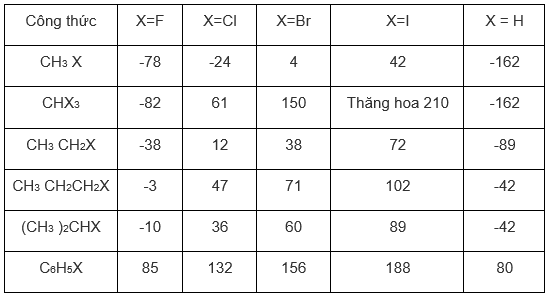
a) Hãy cho biết sự biến đổi nhiệt độ sôi ghi trong bảng có theo quy luật nào không?
b) Hãy ghi nhiệt độ sôi của các hidrocacbon vào cột cuối cùng của bảng và so sánh với nhiệt độ sôi của các dẫn xuất halogen tương ứng rồi rút ra nhận xét.
Phương pháp giải
Chú ý quan trọng: Axit > ancol > amin > este > xeton > anđehit > dẫn xuất halogen > ete > CxHy
Hướng dẫn giải
Câu a: Quy luật biến đổi nhiệt độ sôi
- Ở nhiệt độ thường CH3 F,CH3 Cl,CH3 Br là chất khí; CH3 I là chất lỏng.
- Trong hợp chất RX (R là gốc hidrocacbon , X là halogen)
+ Nhiệt độ sôi tăng dần khi X lần lượt được thay thế bằng F, Cl, Br, I
+ Nhiệt độ sôi tăng dần khi R tăng.
Câu b: Nhiệt sộ sôi dẫn xuất halogen cao hơn nhiệt độ sôi các ankan tương ứng.
- Các hợp chất hữu cơ đồng phân về mạch cacbon thì đồng phân mạch thẳng có nhiệt độ sôi cao hơn đồng phân mạch nhánh do hiệu ứng Van dec Van.
4. Giải bài 4 trang 216 SGK Hóa 11 nâng cao
Hãy ghép các chất được kí hiệu bởi các chữ cái ở cột bên phải vào các loại dẫn xuất halogen ở cột bên trái sao cho phù hợp.
a) Dẫn xuất halogen loại ankyl
b) Dẫn xuất halogen loại ankyl
c) Dẫn xuất halogen loại phenyl
d) Dẫn xuất halogen loại vinyl
A. CH2=CH-CH2-C6H4-Br
B. CH2=CH-CHBr-C6H5
C. CH2=CHBr-CH2-C6H6
D. CH3-C6H4-CH2-CH2Br
Phương pháp giải
Dựa vào tên gốc chức để hoàn thành bài tập
Ví dụ: CH2=CH-Cl (vinyl clorua); CH2=CH-CH2-Cl (anlyl clorua); C6H5CH2Cl (benzyl clorua).
Hướng dẫn giải
a) D
b) B
c) A
d) C
5. Giải bài 5 trang 216 SGK Hóa 11 nâng cao
Hãy viết phương trình hóa học của các phản ứng sau và gọi tên sản phẩm tạo thành:
a) CH3CHBrCH2CH3 với dung dịch NaOH/H2O, đun nóng
b) CH3CHBrCH2CH3 với dung dịch KOH/ancol, đun nóng.
Phương pháp giải
- Các ankyl halogenua không phản ứng với nước nhưng bị thủy phân khi đun nóng với dung dịch kiềm tạo ancol
- Quy tắc Zai-xép: Khi tách HX khỏi dẫn xuất halogen, nguyên tử halogen X ưu tiên tách ra cùng nguyên tử H ở cacbon bậc cao hơn bên cạnh tạo sản phẩm chính.
Hướng dẫn giải
a) CH3-CHBr-CH2-CH3 + NaOH → CH3-CH(OH)-CH2-CH3 + NaBr
b) CH3-CHBr-CH2-CH3 + KOH → CH2=CH-CH2-CH3 + KBr + H2O
CH3CHBr-CH2-CH3 + KOH → CH3-CH=CH-CH3 + KBr + H2O
(sản phẩm chính)
6. Giải bài 6 trang 216 SGK Hóa 11 nâng cao
Hãy hoàn thành các sơ đồ phản ứng tổng hợp PVC và cao su cloropren cho dưới đây và cho biết hiện nay PVC được tổng hợp theo sơ đồ phản ứng nào?
a) CH2=CH2 (+ Cl2) → A (+ NaOH, etanol) → B (xt, to, p) → PVC
b) CH4 (làm lạnh nhanh) → C2H2 (+ HCl) → B (to, xt, p) → PVC
c) 2C2H2 → C4H5 (+ HCl, xt) → C4H5Cl (xt, to,p) → Cao su cloropren
Phương pháp giải
- Các dẫn xuất halogen của etilen, của butađien được dùng làm monome để tổng hợp các polime quan trọng.
Hướng dẫn giải
Câu a:
CH2=CH2 + Cl2 → CH2Cl-CH2Cl
CH2Cl-CH2Cl + NaOH → CH2=CHCl + NaCl + H2O
CH2=CHCl → (-CH2-CHCl-)n (PVC)
Đây là sơ đồ điều chế PVC trong công nghiệp hiện nay.
Câu b:
2CH4 → C2H2 + 3H2 (làm lạnh nhanh)
C2H2 + HCl → CH2=CHCl (HgCl, to)
CH2=CHCl → (-CH2-CHCl-)n (PVC) (đk: HCl, HgCl2 150-200oC)
Câu c:
2C2H2 → CH2=CH-CCH (đk: CuCl, NH4Cl, to)
CH2=CH-CCH + HCl → CH2=CH-C(Cl)=CH2
CH2=CH-C(Cl)=CH2 → (-CH2-CH=C(Cl)-CH2-)n (cao su clopren)
7. Giải bài 7 trang 216 SGK Hóa 11 nâng cao
Hãy phân biệt các chất sau bằng phương pháp hóa học:
a) Hexyl bromua, brombenzen, 1-brombut-2-en.
b) 1-clopent-2en, pent-2-en, 1-clopentan
Phương pháp giải
Dùng dung dịch Br2
Hướng dẫn giải
Câu a: Dùng dung dịch Br2: Mất màu dung dịch Br2 là CH2Br-CH=CH-CH3
CH2Br-CH=CH-CH3 + Br2 → CH2Br-CHBr-CHBr-CH3
- Đun hai mẫu còn lại với dung dịch NaOH, chiết lấy phần nằm dưới (ancol nổi lên trên) cho tác dụng với dung dịch AgNO3 thấy có kết tủa vàng nhạt là hexyl bromua. Mẫu còn lại là benzene.
CH3(CH2)5CH2Br + NaOH → CH3(CH2)5CH2OH + NaBr
NaBr + AgNO3→AgBr + NaNO3
Câu b: Tương tự câu a, dùng dung dịch Br2; hai mẫu làm mất màu dung dịch Br2 là 1-clopent-2-en và pent-2-en. Mẫu còn lại là 1-clopentan. Thủy phân 1-clopent-2-en và pent-2-en, rồi dùng dung dịch AgNO3. Mẫu xuất hiện kết tủa trắng là 1-clopent-2-en.
8. Giải bài 8 trang 216 SGK Hóa 11 nâng cao
Trong công nghiệp, ngày nay ngưởi ta điều chế poli vinylclorua (PVC) theo sơ đồ kĩ thuật như ở hình sau:
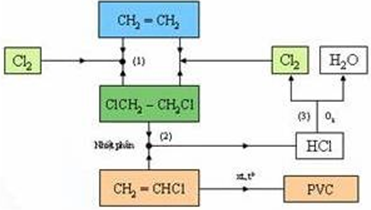
a) Từ sơ đồ kĩ thuật đã cho, hãy viết phương trình hóa học của phản ứng xảy ra ở giai đoạn clo hóa (1), giai đoạn nhiệt phân (2) và giai đoạn chuyển HCl thành Cl2 (3).
b) Nêu ưu điểm của sơ đồ này so với sơ đồ điều chế PVC cho ở câu (a) và (b) Giải bàitập 6.
c) Tính thể tích khí etilen và khí clo (đktc) cần để sản xuất 1 tấn PVC theo sơ đồ trên, giả sử các phản ứng đều đạt hiệu suất 100%.
Phương pháp giải
Để giải bài tập này cần nắm vững phương pháp điều chế PVC
- Viết PTHH của phản ứng
- Tính toán theo phương trình
Hướng dẫn giải
Câu a:
CH2=CH2 + Cl2 →CH2Cl-CH2Cl
CH2Cl-CH2Cl → CH2=CHCl + HCl
4HCl + O2 → 2Cl2 + 2H2O
Câu b: Ưu điểm:
Tận dụng Cl2, chất thải là H2O không gây ô nhiễm môi trường.
Không dùng NaOH và etanol
Câu c: Sơ đồ hợp chức của chu trình điều chế PVC.
nC2H4 → nCl2 → (-CH2-CHCl-)n
Thể tích C2H4 và Cl2 đã dùng ở đktc:
\({V_{{C_2}{H_4}}} = {V_{C{l_2}}} = \frac{{{{10}^6}.22,4n}}{{62,5n}} = 358400(l)\)
Tham khảo thêm
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 52: Luyện tập dẫn xuất hiđrocacbon
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 53: Ancol - Cấu tạo, danh pháp, tính chất vật lí
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 54: Ancol - Tính chất hóa học, điều chế và ứng dụng
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 55: Phenol
- doc Giải bài tập SGK Hóa 11 Nâng cao Bài 56: Luyện tập ancol, phenol
