Hoá học 11 Bài 10: Photpho
Nội dung trọng tâm của bài giảng Photpho là So sánh 2 dạng thù hình chủ yếu của Photpho là P trắng và P đỏ về một số tính chất vật lí. Tính chất hoá học cơ bản của photpho là tính oxi hoá (tác dụng với kim loại Na, Ca...) và tính khử (tác dụng với O2, Cl2).
Mục lục nội dung

1. Tóm tắt lý thuyết
Video 1: Giới thiệu về Phopho
1.1. Vị trí và cấu hình electron nguyên tử
- Cấu hình e: 1s2 2s2 2p6 3s2 3p3.
- Ví trí: Z = 15, chu kì 3, nhóm VA
- Hoá trị có thể có của P: 5 và 3
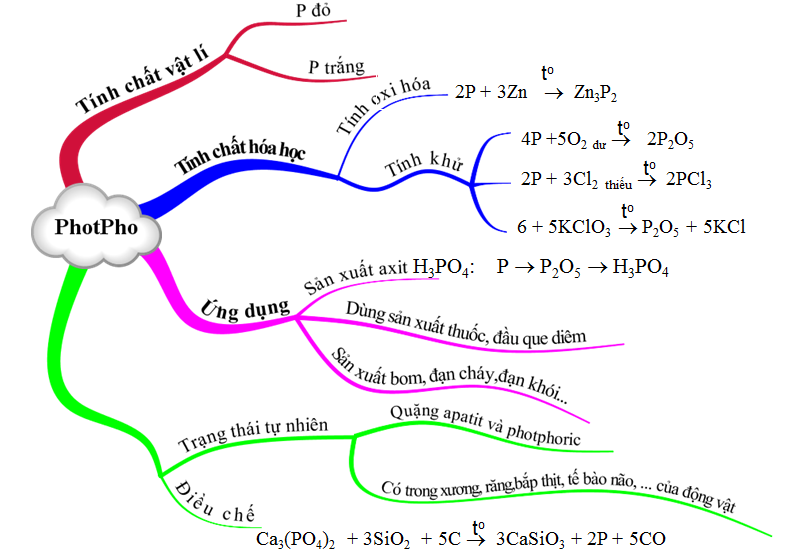
1.2. Tính chất vật lí
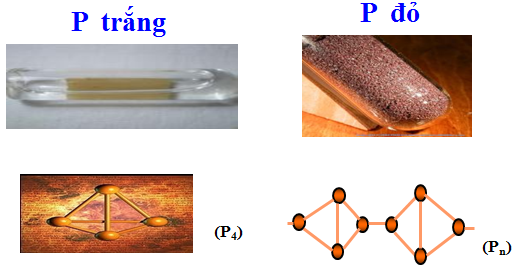
- P trắng:
+ Trạng thái - màu sắc: Chất rắn, trong suốt, màu trắng hoặc hơi vàng
+ Tính tan: Không tan trong nước
+ Tính độc - Tính bền: Không độc - Bền ở điều kiện thường
+ Tính phát quang: Phát quang màu lục nhạt trong bóng tối
- P đỏ:
+ Trạng thái - màu sắc: Chất bột, màu đỏ
+ Tính tan: Không tan trong các dung môi thường
+ Tính độc - Tính bền: Rất độc, gây bỏng nặng khi rơi vào da - Không bền, dễ bốc cháy trong không khí
+ Tính phát quang: Không phát quang trong bóng tối
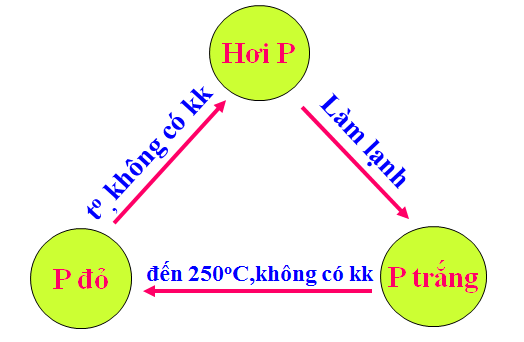
1.3. Tính chất hóa học

a. Tính oxi hoá
P + 3Na → Na3P
2P + 3Ca → Ca3P2 (canxi photphua)
2P + 3Zn → Zn3P2 (Kẽm photphua)
b. Tính khử
- Khi tác dụng với phi kim hoạt động và những chất oxi hoá mạnh.
- Với oxi:
5O2 (dư) + 4P → 2P2O5 (Điphotpho pentaoxit)
3O2 (thiếu) + 4P → 2P2O3 (Điphotpho trioxit)
Video 2: Phản ứng giữa Photpho và Oxi
- Với clo:
5Cl2 (dư) +2P → 2PCl5 (photpho pentaclorua)
3Cl2 (thiếu) + 2P → 2PCl3 (photpho triclorua)
- Với hợp chất: P + 5HNO3 đ,n → H3PO4 + 5NO2 + H2O
1.4. Ứng dụng

1.5. Trạng thái tự nhiên

1.6. Sản xuất
- Trong công nghiệp, photpho đỏ được sản xuất bằng cách nung hỗn hợp quặng photphorit (hoặc apatit), cát và than cốc ở 12000C trong lò điện.
Ca3(PO4)2 + 3 SiO2 + 5C → 5CO + 2Phơi + 3CaSiO3
- Lào Cai là một trong những tỉnh giàu tài nguyên khoáng sản nhất Việt Nam với 35 loại khoáng sản khác nhau. Trong đó có nhiều loại khoáng sản như apatít, đồng, sắt, graphít, nguyên liệu cho gốm, sứ, thuỷ tinh,… với trữ lượng lớn nhất cả nước.
1.7. Tổng kết
2. Bài tập minh họa
2.1. Dạng 1: So sánh tính chất của P trắng và P đỏ
Chọn một phương án đúng để điền cụm từ vào chỗ trống khi so sánh tính chất vật lí của P trắng và P đỏ sau:
- P trắng:
+ Trạng thái, màu sắc: ...
+ Cấu trúc phân tử: ...
+ Tính tan: ...
+ Tính độc: ...
+ Tính bền: ...
+ Khả năng phát quang: ...
- P đỏ:
+ Trạng thái, màu sắc: ...
+ Cấu trúc phân tử: ...
+ Tính tan: ...
+ Tính độc: ...
+ Tính bền: ...
+ Khả năng phát quang: ...
(1) chất rắn, trong suốt, màu trắng hoặc vàng nhạt
(2) cấu trúc polime (Pn)
(3) không tan trong nước, tan trong dung môi hữu cơ
(4) chất bột, màu đỏ
(5) phát quang màu lục nhạt trong bóng tối
(6) không độc
(7) không tan trong các dung môi thông thường
(8) bền ở nhiệt độ thường.
(9) không phát quang trong bóng tối
(10) không bền.
(11) rất độc, gây bỏng nặng khi rơi vào da.
(12) cấu trúc mạng tinh thể ptử (P4)
Hướng dẫn giải
- P trắng:
+ Trạng thái, màu sắc: (1)
+ Cấu trúc phân tử: (12)
+ Tính tan: (3)
+ Tính độc: (11)
+ Tính bền: (10)
+ Khả năng phát quang: (5)
- P đỏ:
+ Trạng thái, màu sắc: (4)
+ Cấu trúc phân tử: (2)
+ Tính tan: (7)
+ Tính độc: (6)
+ Tính bền: (8)
+ Khả năng phát quang: (9)
2.2. Dạng 2: Giải thích khả năng hoạt động của Photpho
Bài 1: Giải thích tại sao ở điều kiện thường photpho hoạt động hơn nitơ mặc dù độ âm điện của photpho (2,19) nhỏ hơn độ âm điện của nitơ (3,04)?
Hướng dẫn giải
Liên kết trong phân tử photpho là liên kết đơn, kém bền vững hơn liên kết ba trong phân tử nitơ. Vì vậy ở điều kiện thường photpho hoạt động hơn nitơ.
Bài 2: Dựa vào khả năng bốc cháy khác nhau của photpho trắng và photpho đỏ, cho biết dạng thù hình nào của photpho hoạt động mạnh hơn?
Hướng dẫn giải
P trắng hoạt động hóa học mạnh hơn P đỏ.
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Cho 7,75 gam photpho tác dụng với một lượng O2 thích hợp thu được 16,15 gam hỗn hợp chất rắn X (chỉ chứa hợp chất). Khối lượng của chất có khối lượng lớn nhất trong X là?
Câu 2: Để oxi hóa hoàn toàn 14,88 gam photpho thành điphotpho pentaoxit cần dùng vừa hết m gam KClO3 (to). Giá trị của m là?
Câu 3. Tổng hệ số (nguyên, tối giản) của các chất trong phản ứng điều chế P từ quặng photphorit, cát và than cốc trong lò điện là?
Câu 4. Đốt cháy hoàn toàn 6,2 gam photpho bằng oxi dư rồi cho sản phẩm tạo thành tác dụng vừa đủ với m gam dung dịch NaOH 32%, thu được muối Na2HPO4. Giá trị của m là?
Câu 5. Để oxi hóa hoàn toàn 14,88 gam photpho thành điphotpho pentaoxit cần dùng vừa hết m gam KClO3 (to). Giá trị của m là?
3.2. Bài tập trắc nghiệm
Câu 1: Cho phản ứng: P + KClO3 P2O5 + KCl. Vai trò của P trong phương trình phản ứng trên là:
A.Chất oxi hóa
B. Môi trường
C. Chất khử
D. Chất xúc tác
Câu 2: Trong công nghiệp, photpho được điều chế từ:
A. Ca3(PO4)2; SiO2; C
B. H3PO4; Mg
C. Ca3(PO4)2; C
D. P2O5; C
Câu 3: Chọn công thức đúng của apatit:
A. Ca3(PO4)2;
B. Ca(PO3)2.
C. 3Ca3(PO4)4.CaF2.
D. CaP2O7.
Câu 4: Ở điều kiện thường, photpho hoạt động hoá học mạnh hơn nitơ là do :
A. độ âm điện của photpho lớn hơn của nitơ.
B. ái lực electron của photpho lớn hơn của nitơ.
C. liên kết trong phân tử photpho kém bền hơn trong phân tử nitơ.
D. tính phi kim của nguyên tử photpho mạnh hơn của nitơ.
Câu 5: Hai khoáng vật chính của photpho là :
A. Apatit và photphorit.
B. Photphorit và cacnalit
C. Apatit và đolomit.
D. Photphorit và đolomit.
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Photpho Hóa học 11 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Vị trí trong bảng tuần hoàn, cấu hình electron nguyên tử của nguyên tố photpho.
- Các dạng thù hình, tính chất vật lí (trạng thái, màu sắc, khối lượng riêng, tính tan, độc tính), ứng dụng, trạng thái tự nhiên và điều chế photpho trong công nghiệp.
- Tính chất hoá học cơ bản của photpho là tính oxi hoá (tác dụng với kim loại Na, Ca...) và tính khử (tác dụng với O2, Cl2).
Tham khảo thêm
- doc Hoá học 11 Bài 7: Nitơ
- doc Hoá học 11 Bài 8: Amoniac và muối amoni
- doc Hoá học 11 Bài 9: Axit nitric và muối nitrat
- doc Hoá học 11 Bài 11: Axit photphoric và muối photphat
- doc Hoá học 11 Bài 12: Phân bón hóa học
- doc Hoá học 11 Bài 13: Luyện tập
- doc Hoá học 11 Bài 14: Bài thực hành 2 Tính chất của một số hợp chất nitơ, photpho
