Hoá học 11 Bài 32: Ankin
Nội dung bài học Ankin tìm hiểu khái niệm đồng đẳng, đồng phân, danh pháp & CTPT của ankin; Phương pháp điều chế, ứng dụng của axetilen. Sự giống và khác về tính chất hoá học giữa ankin và anken.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Đồng đẳng, đồng phân, danh pháp
Ankin: là những hidrocacbon mạch hở có 1 liên kết 3 (C≡C) trong phân tử.
a. Dãy đồng đẳng của ankin
Dãy đồng đẳng của ankin: C2H2, C3H4, … CnH2n-2 (n ≥2)
Công thức electron:
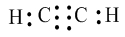
Công thức cấu tạo: \(H - C \equiv C - H\)
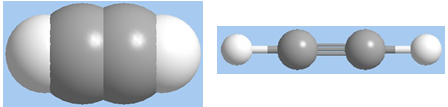
b. Đồng phân
Hai chất đầu dãy C2, C3 không có đồng phân ankin.
Các ankin từ C4 trở lên có đồng phân vị trí liên kết ba
Từ C5 còn có đồng phân mạch Cacbon (tương tự anken)
Ví dụ: Đồng phân C4H6
CH≡C−CH2−CH3: but-1-in (Etyl axetilen)
CH3−C≡C−CH3: but-2-in (Đimetyl axetilen)
Ví dụ: Đồng phân C5H8
CH≡C−CH2−CH2−CH3: pent-1-in (Propyl axetilen)
CH≡C-CH(CH3)-CH3 : 3-metyl but-1-in (isopropyl axetilen)
CH3−C≡C−CH2−CH3: pent-2-in (Etyl metyl axetilen)
c. Danh pháp
- Tên thông thường
CH≡CH; Axetilen
CH≡CH-CH2-CH3: Etyl axetilen
CH3-CH2-CH2-C≡CH: Đimetyl axetilen
CH3-CH2-CH2-C≡CH: Propylaxetilen
- Tên thay thế:
Số chỉ vị trí-tên nhánh|tên mạch chính|-số chỉ vị trí-in
Các ankin có liên kết ba đầu mạch (dạng \(R - C \equiv CH\))
1.2. Tính chất vật lí
Ankin có nhiệt độ sôi tăng dần theo chiều tăng của phân tử khối.
Ankin có nhiệt độ sôi cao hơn và khối lượng riêng lớn hơn các anken tương ứng.
Các ankin không tan trong nước và nhẹ hơn nước.
1.3. Tính chất hóa học
Nguyên tử C của liên kết 3 ở trạng thái lai hoá sp (lai hoá phẳng) → (HCC) = 1800.
Liên kết 3 C≡C gồm 1 liên kết \(\sigma\) và 2 liên kết
a. Phản ứng cộng
- Cộng Hidro
Dùng Pb/PdCO3 hoặc Pd/BaSO4. Ankin chỉ cộng một phân tử hidro tạo anken.
CH≡CH + H2 → CH2=CH2
CH≡CH + 2H2 → CH3 ─ CH3
- Cộng Br2:
- Cộng HCl
CH≡CH + HCl → CHCl=CH2
CHCl=CH2 +HCl → CHCl2─CH3
CH3-C≡CH + HCl → CH3-CCl=CH2 (+HCl) → 2,2, điclopropan
- Cộng nước (hiđrat hoá)
CH≡CH + H2O → [CH2=CH─OH] (không bền) → CH3CHO (anđehit axetic)
Lưu ý: Phản ứng cộng HX, H2O vào các ankin trong dãy đồng đẳng của axetilen cũng tuân theo quy tắc Maccopnhicop như anken.
- Phản ứng đimehoá, trimehoá.
2 CH≡CH → CH2 = CH─C≡CH
3 CH≡CH → C6H6
b. Phản ứng thế bằng ion kim loại
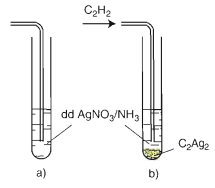
CH≡CH + 2AgNO3 + 2 NH3 → AgC≡CAg ↓vàng + 2 NH4NO3
Nguyên tử H đính với C mang liên kết 3 linh động hơn rất nhiều so với C liên kết đôi, đơn => nó có thế bởi ion KL.
Phản ứng này dùng để nhận biết các ankin 1 (có liên kết 3 ở đầu mạch)
RC≡CH + 2 AgNO3 + 2 NH3→ RC≡CAg + 2 NH4NO3
c. Phản ứng oxi hoá
- Phản ứng oxi hoá hoàn toàn
2CnH2n-2 + (3n -1)O2 → 2n CO2 + 2(n-1) H2O
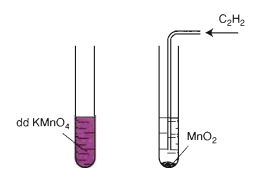
- Phản ứng oxi hoá không hoàn toàn
Mất màu KMnO4
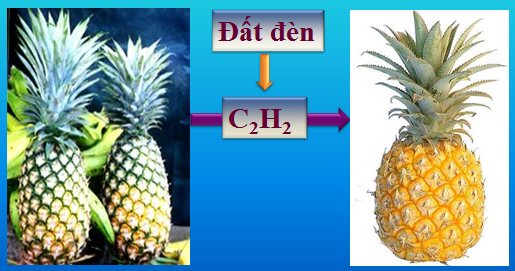
1.4. Điều chế
a. Phòng thí nghiệm
CaC2 + H2O → Ca(OH)2 + C2H2 ↑
b. Công nghiệp
Đi từ dầu mỏ:
2 CH4 → C2H2 + 3 H2 (ĐK: 1500oC)
Đi từ đá vôi:
CaCO3 → CaO → CaC2 → C2H2
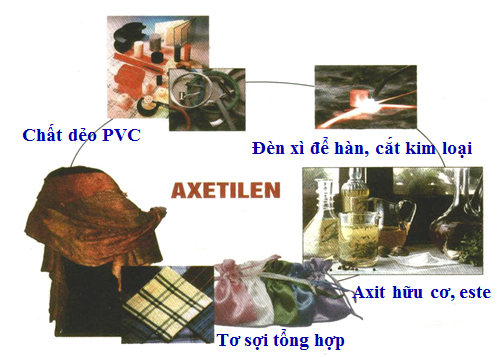
1.5. Ứng dụng
Dùng trong CN hàn cắt KL
Nguyên liệu tổng hợp chất hữu cơ cơ bản.
2. Bài tập minh họa
2.1. Dạng 1: Bài tập đồng phân, danh pháp của Ankin
Viết CTCT các ankin có tên sau: (1) iso-butylaxetilen, (2) metyl iso-propylaxetilen, (3) 3-metylpen-1-in, (4) 2,2,5,5-tetrametylhex-3-in
Hướng dẫn giải
(1) (CH3)2-CH-CH2-C≡CH
(2) CH3-C≡C-CH(CH3)2
(3) CH≡C-CH(CH3)-CH2-CH3
(4) CH3-C(CH3)2-C≡C-C(CH3)2-CH3
2.2. Dạng 2: Bài tập phản ứng cộng của Ankin
Một hỗn hợp X gồm 0,12 mol C2H2 và 0,18 mol H2. Cho X đi qua Ni nung nóng, sau một thời gian thu được hỗn hợp khí Y. Cho Y vào bình đựng brom dư, thấy bình brom tăng m gam và thoát ra khí Z. Đốt cháy hết Z và cho toàn bộ sản phẩm cháy vào bình đựng dung dịch Ca(OH)2 dư thấy có 5 gam kết tủa xuất hiện và thấy khối lượng dung dịch giảm 1,36 gam. Tính giá trị của m ?
Hướng dẫn giải
Khối lượng hỗn hợp X: mX = 0,12.26 + 0,18.2 = 3,48 g
Cho X đi qua Ni nung nóng:
Phương trình phản ứng: C2H2 + H2 → C2H4; C2H2 + 2H2 → C2H6
Hỗn hợp Y gồm: C2H2, C2H4, C2H6 và H2
Cho Y qua bình đựng Br2 dư có C2H2, C2H4 bị giữ lại. Hỗn hợp Z gồm: C2H6 và H2
Phương trình phản ứng: C2H4 + Br2 → C2H4Br2; C2H2 + 2Br2 → C2H2Br4
Đốt cháy Z thu được CO2 và H2O:
nCO2 = nCaCO3 = 0,05 mol.
mdd giảm = m↓ - (mH2O + mCO2) ⇒ mH2O = 5 - 1,36 – 0,05.44 = 1,44 g
Số mol H2O: nH2O = 1,44/18 = 0,08 mol ⇒ mZ = 0,08.2 + 0,05.12 = 0,76 g
Khối lượng bình brom tăng: m = mX - mZ = 3,48 – 0,76 = 2,72 g
2.3. Dạng 3: Bài tập phản ứng đốt cháy
Đốt cháy hoàn toàn hiđrocacbon X, dẫn toàn bộ sản phẩm lần lượt đi qua bình 1 đựng H2SO4 dư, bình 2 đựng 400ml dd Ca(OH)2 0,5M, không có khí đi ra khỏi bình 2. Kết thúc phản ứng thấy khối lượng bình 1 tăng lên 3,6 gam, bình 2 có 10 gam kết tủa trắng. Xác định CTPT của X ?
Hướng dẫn giải
Số mol Ca(OH)2 là: nCa(OH)2 = 0,5.0,4 = 0,2 mol;
Khối lượng bình 1 tăng là khối lượng của H2O: mH2O = 3,6/18 = 0,2 mol
Số mol CaCO3: nCaCO3 = 10/100 = 0,1 mol
TH1: Khí CO2 đi vào bình 2 chỉ sinh ra CaCO3:
nCO2 = nCaCO3 = 0,1 mol
nH2O > nCO2 ⇒ hidrocacbon X là ankan.
Số mol ankan là: nankan = 0,2 – 0,1 = 0,1 mol.
Phương trình đốt cháy:
CnH2n+ 2 + (3n+1)/2 O2 → nCO2 + (n+1)H2O
0,1 0,1 mol
Ta có : 0,1n = 0,1 ⇒ n =1. Vậy CTPT của X là CH4
TH2: Khí CO2 đi vào bình 2 tạo ra 2 muối là CaCO3 và Ca(HCO3)2
nCa(HCO3)2 = 0,2 – 0,1 = 0,1 mol
Bảo toàn nguyên tố C ta có: nCO2 = 0,1.2 + 0,1 = 0,3 mol
nCO2 > nH2O ⇒ Hidrocacbon là ankin
Phương trình đốt cháy: CnH2n-2 + (3n - 1)/2 O2 → nCO2 + (n - 1)H2O
Số mol ankin là: nankin = 0,3 – 0,2 = 0,1 mol
Theo phương trình ta có: 0,1n = 0,3 ⇒ n = 3 . Vậy CTPT của ankin là: C3H4
2.4. Dạng 4: bài tập phản ứng của Ankin với Bạc Nitrat (AgNO3)
Bài 1: Hỗn hợp khí X gồm etilen và propin. Cho a mol X tác dụng với dung dịch AgNO3 trong NH3, thu được 17,64 gam kết tủa. Mặt khác a mol X phản ứng tối đa với 0,34 mol H2. Giá trị của a là
Hướng dẫn giải
nC3H4 = nC3H3Ag = 17,64/147 = 0,12 mol
nC2H4 + 2nC3H4 = nH2 ⇒ nC2H4 = 0,1 mol ⇒ a = nC2H4 + nC3H4 = 0,22 mol
Bài 2: Hỗn hợp X gồm metan, etilen, axetilen. Sục 7 gam X vào nước brom dư thì thấy có 48 gam brom pư. Cho 7 gam trên pư với AgNO3 dư trong NH3 thì thu được 24 gam kết tủa. Tính khối lượng mỗi chất trong X?
Hướng dẫn giải
Gọi số mol của metan, etilen, axetilen lần lượt là x, y, z ta có: 16x + 28y + 26z = 7 (1)
Phương trình phản ứng:
C2H4 + Br2 → C2H4Br2
y………y
C2H2 + 2Br2 → C2H2Br4
z………2z
số mol brom phản ứng: nBr2 = 48/160 = 0,3 mol = y + 2z (2)
C2H2 + 2AgNO3 + 2NH3 → C2H2Ag2↓ + 2NH4NO3.
z……………………………….z
Số mol kết tủa: n↓ = 24/240 = 0,1 mol = z (3)
Từ (1), (2), (3) ta có: x = y = z = 0,1 mol
Khối lượng mỗi chất trong X là:
mmetan = 0,1.16 = 1,6 gam; metilen = 0,1.28 = 2,8 gam; maxetilen = 0,1.26 = 2,6 gam
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Cho 3,36 lít Hiđrocacbon X (đktc) phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, thu được 36 gam kết tủa. Công thức phân tử của X là?
Câu 2: Hỗn hợp khí X gồm etilen và propin. Cho a mol X tác dụng với dung dịch AgNO3 trong NH3, thu được 17,64 gam kết tủa. Mặt khác a mol X phản ứng tối đa với 0,34 mol H2. Giá trị của a là?
Câu 3: Đốt cháy hoàn toàn hỗn hợp X gồm 2 ankin có tỷ lệ mol 1 : 1 thì thu được 15,68 lít CO2 (đktc) và 9,0 gam H2O. Vậy công thức phân tử của 2 ankin là?
Câu 4: Nhiệt phân metan ở 1500oC trong thời gian rất ngắn, toàn bộ khí sau phản ứng cho qua dung dịch AgNO3 dư trong amoniac thì thu được 24,0 gam kết tủa. Khí thoát ra được đốt cháy hoàn toàn thì thu được 9,0 gam H2O. Tính hiệu suất phản ứng nhiệt phân?
3.2. Bài tập trắc nghiệm
Câu 1: Chất X có công thức: CH3 – CH(CH3) – C CH. Tên thay thế của X là
A. 2-metylbut-2-en
B. 3-metylbut-1-in
C. 3-metylbut-1-en
D. 2-metylbut-3-in
Câu 2: Số liên kết σ trong mỗi phân tử etilen; axetilen;buta-1,2- đien lần lượt là
A. 3; 5; 9
B. 5; 3; 9
C. 4; 2; 6
D. 4; 3; 6
Câu 3: Chất nào sau đây tác dụng với dung dịch AgNO3 trong NH3 tạo kết tủa?
A. CH3 – CH = CH2
B. CH2 – CH – CH = CH2.
C. CH3 – C ≡ C – CH3
D. CH3 – CH2 – C ≡ CH2
Câu 4: Có bao nhiêu đồng phân ankin C5H8 tác dụng với dung dịch AgNO3 trong NH3 ?
A.3
B. 2
C. 4
D. 1
Câu 5: 4 gam một ankin X có thể làm mất tối đa 200m, dung dịch Br2 1M. Công thức phân tử của X là
A.C5H8
B. C2H2
C. C3H4
D. C4H6
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Ankin Hóa học 11 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Khái niệm đồng đẳng, đồng phân, danh pháp & CTPT của ankin
- Phương pháp điều chế, ứng dụng của axetilen. Sự giống và khác về tính chất hoá học giữa ankin và anken.
