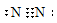Hoá học 11 Bài 7: Nitơ
Nitơ là nguyên tố có nhiều chuyện lạ: nó là 1 khí không duy trì sự sống nhưng không có cuộc sống nào lại không có mặt nitơ. Lịch sử tìm ra nitơ gắn liền việc tìm ra thành phần không khí và các chất khí như oxi, hiđro. Lúc đầu người ta đặt tên nitơ là azot (nghĩa là ko duy trì sự sống), về sau phát hiện nó chứa trong diêm tiêu nên đặt tên là NITROGEN (sinh ra diêm tiêu). Vậy nitơ có cấu tạo và tính chất như thế nào, dựa vào đó chúng ta sẽ biết những ứng dụng của nitơ trong sản xuất và đời sống. Vậy Nitơ có tính chất vật lí, hóa học, cách điều chế như thế nào chúng ta cùng nhau đi vào nội dung bài học ngày hôm nay.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Vị trí và cấu hình electron nguyên tử
- Vị trí nitơ: ô thứ 7, chu kỳ 2, nhóm VA.
- Cấu hình e: 1s22s22p3
- Cấu tạo phân tử nitơ:
+ CTPT: N2.
+ Công thức electron:
+ CTCT: N≡N
⇒ 2 nguyên tử trong phân tử nitơ có 3 liên kết cộng hóa trị không cực.
1.2. Tính chất vật lí
Ở đk thường:
- Là chất khí không màu, không mùi, không vị.
- dN2/ kk = 28/29 ⇒ hơi nhẹ hơn kk.
- Hóa lỏng ở -1960C, hóa rắn ở -2100C.
- Rất ít tan trong nước.
- Không duy trì sự cháy và sự sống.
1.3. Tính chất hóa học
- Nitơ là phi kim khá hoạt động (độ âm điện = 3), nhưng ở nhiệt độ thường khá trơ về mặt hóa học. Do 2 nguyên tử N liên kết với nhau bằng 1liên kết ba không phân cực nên rất bền do năng lượng liên kết lớn, nên nitơ khá trơ về mặt hóa học ở nhiệt độ thường.
- Số oxi hóa của nitơ trong hợp chất với hidro, kim loại là -3, trong hợp chất với oxi, flo là từ +1 → +5.
- Tùy thuộc vào sự thay đổi số oxi hóa, nitơ có thể thể hiện tính khử hay tính oxi hóa. (chủ yếu là tính oxi hóa).
a. Tính oxi hóa
* Tác dụng với kim loại: (kim loại mạnh như Li, Na, K, Mg, Ba...)
- Liti là kim loại duy nhất tác dụng được với Nitơ ở nhiệt độ thường: 6Li + N2 → 2Li3N (Liti nitrua)
- Ở nhiệt độ cao, Nitơ tác dụng được với một số kim loại hoạt động như Ca, Mg, Al tạo nitrua kim loại:
3Mg + N2 → Mg3N2 (Magie nitrua)
*Tác dụng với hidro: 3H2 + N2 ⇔ 2NH3 (đk: 450oC, xt Fe)
b. Tính khử

- Ở nhiệt độ khoảng 30000C (hoặc hồ quang điện, hoặc tia lửa điện hình thành sấm sét) đã cung cấp năng lượng cho phản ứng nitơ kết hợp trực tiếp với O2 tạo nitơ monoxit NO
N2 + O2 ⇔ 2NO (xt: hồ quang điện)
- NO kết hợp dễ dàng với oxi: 2NO + O2 ⇔ 2NO2
- Một số oxit khác của nitơ như: N2O, N2O3, N2O5 chúng ko điều chế trực tiếp từ nitơ và oxi.
* Kết luận: N2 thể hiện tính khử khi td với nguyên tố có độ âm điện lớn hơn (như O2), thể hiện tính oxi hóa khi tác dụng với nguyên tố có độ âm điện nhỏ hơn như (kim loại mạnh, H2).
1.4. Ứng dụng
- Là thành phần cấu tạo nên protêin, thành phần dinh dưỡng chính của thực vật. N2 có nhiệt độ sôi thấp nên dùng làm lạnh trong công nghiệp và trong phòng thí nghiệm.
- Công nghiệp:
+ Tổng hợp NH3, sản xuất HNO3, phân đạm…
+ Môi trường trơ trong luyện kim, thực phẩm, điện tử…
- Y tế: N2 lỏng: bảo quản mẫu máu, các mẫu vật sinh học khác…
+ Dựa vào tính trơ của nitơ mà bảo quan tranh vẽ trong viện bảo tàng chứa đầy khí nitơ trong ống của cuộn tranh tránh các phân tử khác bị oxi hóa hư màu vẽ.
+ Bơm vào bóng đèn điện để giảm sự bốc hơi kim loại trên bề mặt dây tóc.
+ Bơm nitơ vào phổi bệnh nhân lao để ép lá phổi cho nó nghỉ ngơi…
1.5. Trạng thái tự nhiên
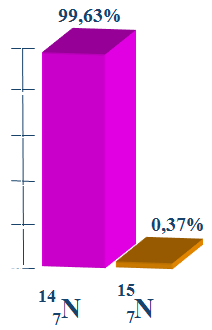
- Ở dạng hợp chất, nitơ có nhiều trong khoáng chất natri nitrat NaNO3 với tên gọi là diêm tiêu natri
1.6. Điều chế
a. Trong công nghiệp
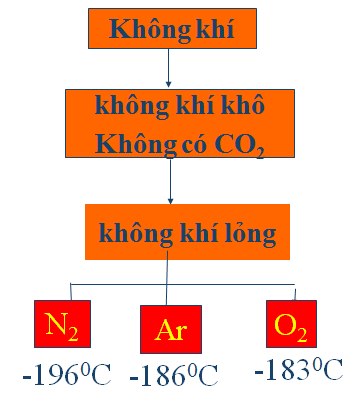
b. Trong phòng thí nghiệm
NH4NO2 → N2 + 2H2O
NH4Cl + NaNO2 → NaCl + N2 + 2H2O
2. Bài tập minh họa
2.1. Dạng 1: Phương pháp nhận biết các chất trong Nhóm Nitơ
Bài 1: Chỉ dùng 1 thuốc thử hãy nhận biết các dung dịch
a) Na2CO3; (NH4)3PO4; NH4Cl; NaNO3.
b) NH4Cl; (NH4)2SO4; BaCl2; KNO3.
Hướng dẫn giải
Lấy mẫu thử đánh số
a. Cho Ba(OH)2 vào từng mẫu thử
- Na2CO3 có kết tủa trắng BaCO3
- (NH4)3PO4 có khí mùi khai thoát ra và có kết tủa trắng BaSO4
- NH4Cl có khí mùi khai thoát ra NH3
- NaNO3 không có hiện tượng.
b. Cho Ba(OH)2 vào từng mẫu thử.
- NH4Cl có khí mùi khai thoát ra NH3
- (NH4)2SO4 có khí mùi khai thoát ra và có kết tủa trắng BaSO4
- 2 chất còn lại ko có hiện tượng.
+ Lấy (NH4)2SO4 cho vào 2 chất đó
* Cái nào có kết tủa trắng đó là BaCl2 còn lại là KNO3 không hiện tượng
Bài 2: Chỉ được dùng một kim loại, làm thế nào phân biệt những dung dịch sau đây: NaOH, NaNO3, HgCl2, HNO3, HCl.
Hướng dẫn giải
Dùng kim loại Al, cho Al tác dụng lần lượt với các mẫu thử
Nếu có khí màu nâu bay ra là HNO3:
Al + 4HNO3 → Al(NO3)3 + NO↑ + 2H2O
2NO + O2 → 2NO2 (màu nâu)
Nếu có kim loại trắng sinh ra là HgCl2
2Al + 3HgCl2 → 3Hg + 2AlCl3
Có bọt khí bay ra, có kết tủa và tủa tan ra là:
NaOH + 2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2
Có bọt khí bay ra là HCl
2Al + 6HCl → 2AlCl3 + 3H2↑
Còn lại là NaNO3
2.2. Dạng 2: Cách viết và cân bằng phương trình hóa học Nhóm Nitơ
Bài 1: Hoàn thành các phương trình hóa học giữa các chất sau.cho biết phản ứng nào thể hiện tính oxi hóa mạnh?phản ứng thể hiện tính axit.
a) HNO3 + NaOH
b) HNO3(l) + CuO
c) HNO3(l) + FeCO3
d) HNO3(đặc,nóng) + S
e) HNO3(đặc nóng) + Fe(OH)2
Hướng dẫn giải
a) HNO3 + NaOH → NaNO3 + H2O
b) 2HNO3 + CuO → Cu(NO3)2 + H2O
c) 10HNO3 loãng + 3FeCO3 → 3Fe(NO3)3 + 3CO2 + NO + 5H2O
d) 6HNO3 đặc + S −tº→ H2SO4 + 6NO2 + 2H2O
e) 4HNO3 đặc + Fe(OH)2 −tº→ Fe(NO3)3 + NO2 + 3H2O
- PƯ thể hiện tính acid của HNO3: a, b.
- PƯ thể hiện tính OXH của HNO3: c, d, e.
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Để phân biệt các dung dịch axit HCl, HNO3, H2SO4 và H3PO4, người ta dùng thêm kim loại nào?
Câu 2: Để phân biệt các mẫu phân bón sau : (NH4)2SO4, NH4Cl và Ca(H2PO4)2 cần dùng thuốc thử là?
Câu 3: Tính tổng hệ số cân bằng của phản ứng sau: Al + NaNO3 + NaOH + H2O → NaAlO2 + NH3?
Câu 4: Cho Mg tác dụng với dd HNO3 loãng tạo khí N2O (là sản phẩm khử duy nhất). Tổng các hệ số trong phương trình hoá học là?
3.2. Bài tập trắc nghiệm
Câu 1: Cho các phản ứng sau :
(1) Cu(NO3)2 tº→
(2) NH4NO2 tº→
(3) NH3 + O2 tº→
(4) NH3 + Cl2 tº→
(5) NH4Cl tº→
(6) NH3 + CuO tº→
Trong các phản ứng trên, những phản ứng tạo ra khí N2 là
A. (2),(4),(6).
B. (3),(5),(6).
C. (1),(3),(4).
D. (1),(2),(5).
Câu 2: Cho các phản ứng sau :
(1) NH4Cl tº→
(2) NH4NO3 tº→
(3) NH4NO2 + NaOH tº→
(4) Cu + HCl + NaNO3 tº→
(5) (NH4)2CO3 tº→
Trong các phản ứng trên, số phản ứng tạo thành khí NH3 là
A. 2.
B. 3.
C. 4.
D. 5.
Câu 3: Cho 2 muối X, Y thỏa mãn điều kiện sau:
X + Y → không xảy ra phản ứng.
X + Cu → không xảy ra phản ứng.
Y + Cu → không xảy ra phản ứng.
X +Y + Cu → xảy ra phản ứng.
X và Y là:
A. Mg(NO3)2 và KNO3
B. Fe(NO3)3 và NaHSO4.
C. NaNO3 và NaHCO3
D. NaNO3 và NaHSO4.
Câu 4: Thuốc thử dùng để nhận biết ion PO43- trong dung dịch muối photphat :
A. Quỳ tím
B. Dung dịch NaOH
C. Dung dịch AgNO3
D. Dung dịch NaCl
Câu 5: Hoá chất để phân biệt ba dd riêng biệt: HCl, HNO3, H2SO4:
A. Dùng giấy quỳ tím, dd bazơ
B. Dùng muối tan Ba2+, Cu kim loại
C. Dùng dd muối tan của Ag+
D. Dùng dd phenolphtalein, giấy quỳ tím.
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Nitơ Hóa học 11 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
-
Vị trí của nitơ trong bảng tuần hoàn
-
Cấu hình electron và cấu tạo phân tử nitơ
-
Tính chất hóa học của nitơ, ứng dụng của nitơ và điều chế nitơ.
Tham khảo thêm
- doc Hoá học 11 Bài 8: Amoniac và muối amoni
- doc Hoá học 11 Bài 9: Axit nitric và muối nitrat
- doc Hoá học 11 Bài 10: Photpho
- doc Hoá học 11 Bài 11: Axit photphoric và muối photphat
- doc Hoá học 11 Bài 12: Phân bón hóa học
- doc Hoá học 11 Bài 13: Luyện tập
- doc Hoá học 11 Bài 14: Bài thực hành 2 Tính chất của một số hợp chất nitơ, photpho