Hoá học 11 Bài 20: Mở đầu về hóa học hữu cơ
Nội dung bài giảng Mở đầu về hóa học hữu cơ tìm hiểu về khái niệm hoá học hữu cơ và hợp chất hữu cơ, đặc điểm chung của các hợp chất hữu cơ; Phân loại hợp chất hữu cơ theo thành phần nguyên tố (hiđrocacbon và dẫn xuất); Các loại công thức của hợp chất hữu cơ: Công thức chung, công thức đơn giản nhất, công thức phân tử và công thức cấu tạo; Sơ lược về phân tích nguyên tố: Phân tích định tính, phân tích định lượng.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Khái niệm về hợp chất hữu cơ và hoá học hữu cơ
Hợp chất hữu cơ là hợp chất của cacbon (trừ các oxít của cacbon, muối cacbonat, xianua và các bua…)
Hoá học hữu cơ là ngành hoá học nghiên cứu các hợp chất hữu cơ.
1.2. Phân loại hợp chất hữu cơ
a. Dựa vào thành phần các nguyên tố
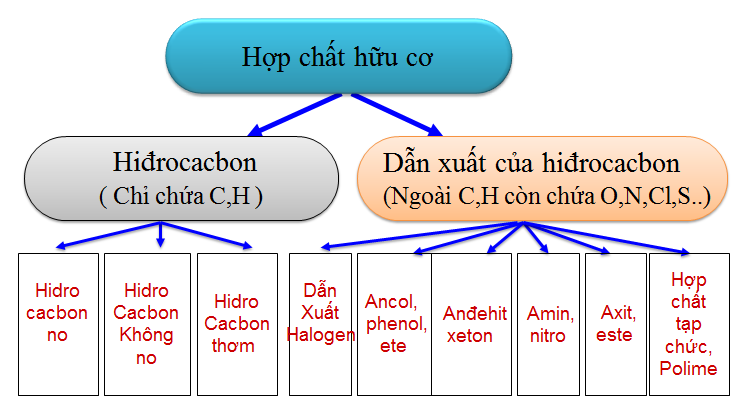
b. Theo mạch cacbon
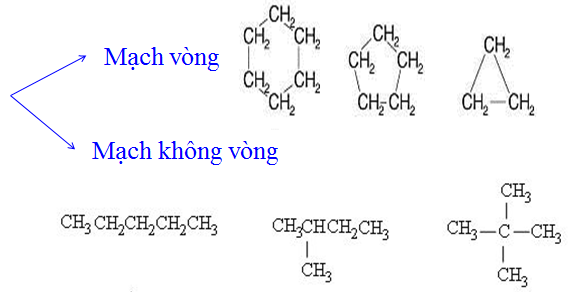
1.3. Đặt điểm chung của hợp chất hữu cơ
a. Đặc điểm cấu tạo
Nguyên tố bắt buộc có là cacbon
Thường gặp H, O, N, S , P , Hal . . .
Liên kết hóa học chủ yếu trong chất hữu cơ là liên kết cộng hóa trị.
b. Tính chất vật lý
Các hợp chất hữu cơ thường dễ bay hơi (tonc, to bay hơi thấp )
Kém bền đối với nhiệt và dễ cháy
Không tan hoặc ít tan trong nước, tan trong dung môi hữu cơ
c. Tính chất hóa học
Kém bền với nhiệt, dễ bị phân hủy.
Các phản ứng của hợp chất hữu cơ thường chậm và không hoàn toàn theo một hướng nhất định→ Thu được hỗn hợp sản phẩm
1.4. Sơ lượt về phân tích nguyên tố
a. Phân tích định tính
Mục đích: Xác định các nguyên tố có trong hợp chất hữu cơ.
Nguyên tắc: Chuyển hợp chất hữu cơ thành các chất vơ cơ đơn giản, rồi nhận biết bằng phản ứng đặc trưng.
Phương pháp tiến hành
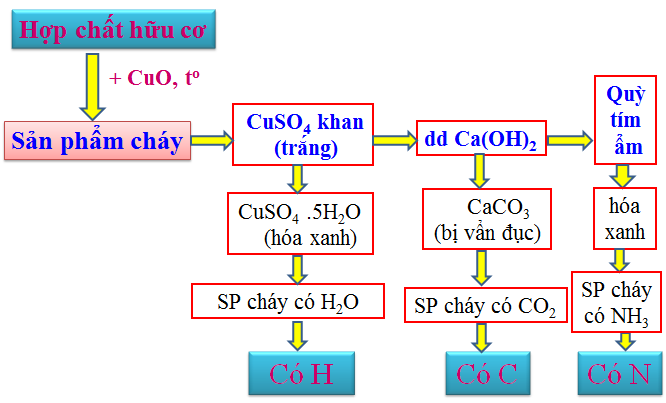
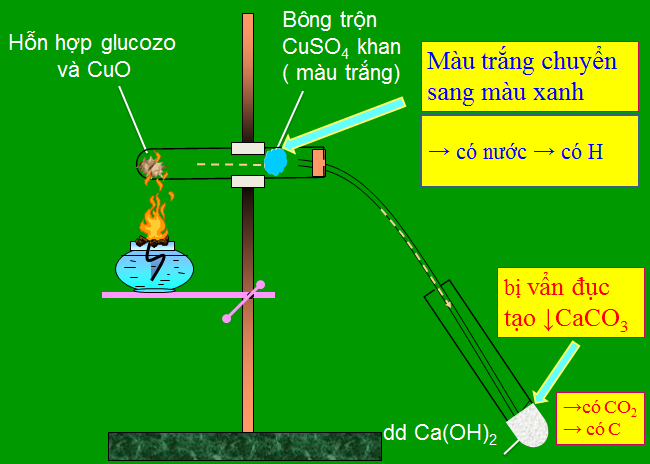
b. Phân tích định lượng
Mục đích: Xác định thành phần phần trăm về khối lượng các nguyên tố có trong hợp chất hữu cơ.
Nguyên tắc
Cân một lượng chính xác hợp chất hữu cơ
Chuyển nguyên tố trong hợp chất hữu cơ thành các chất vô cơ đơn giản như CO2 , H2O , N2…
Xác định m hoặc V của CO2, H2O, N2… Từ đó tính m và %m của các nguyên tố trong hợp chất hữu cơ.
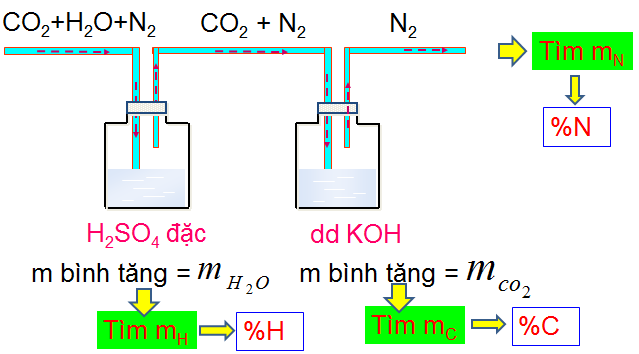
Biểu thức tính
\(\begin{array}{*{20}{l}}
{{m_C} = \frac{{{m_{C{O_2}}}}}{{44}}.12 \Rightarrow \% C = \frac{{{m_C}}}{a}.100\% }\\
{{m_H} = 2.\frac{{{m_{{H_2}O}}}}{{18}} \Rightarrow \% H = \frac{{{m_H}}}{a}.100\% }\\
{{m_N} = 2.\frac{{{V_{{N_2}}}}}{{22,4}}.14 \Rightarrow \% N = \frac{{{m_N}}}{a}.100\% }\\
{\% O = 100\% - (\% C + \% H + \% N + ...)}
\end{array}\)
2. Bài tập minh họa
2.1. Dạng 1: Xác định sự có mặt nguyên tố, thành phần các nguyên tố
Bài 1: Đốt cháy hoàn toàn 0,282g hợp chất hữu cơ A, sản phẩm sinh ra cho qua bình đựng CaCl2 khan và bình đựng NaOH, thấy bình đựng CaCl2 tăng thêm 0,194g, bình đựng NaOH tăng thêm 0,8g. Mặt khác đốt cháy lượng chất A trên thu được 22,4ml khí Nitơ (đktc). Thành phần % khối lượng các nguyên tố trong A là:
A. %mC = 9,93%; %mH = 4,97%; %mN = 85,1%
B. %mC = 78,01%; %mH = 7,09%; %mN = 14,9%
C. %mC = 78,01%; %mH = 7,09%; %mN = 9,93%; %mO = 4,97%
D. %mC = 9,93%; %mH = 4,97%; %mN = 78,01%; %mO = 7,09%
Hướng dẫn giải
Cho sản phẩm cháy qua bình đựng CaCl2, H2O bị giữ lại:
m1 = 0,194 ⇒ mH2O = 0,194g
⇒ nH = 2nH2O = 2. 0,194/18 = 0,02mol
Qua bình đựng NaOH, CO2 bị giữ lại: m2 = 0,8 ⇒ mCO2 = 0,8g
⇒ nC = nCO2 = 0,8/44 = 1/18
mC = 12. 1/18 = 0,22g
nN = 2nN2 = 2. (0,0224 : 22,4) = 0,002 mol ⇒ mN = 0,028g
Ta có mC + mH + mN < mA ⇒ A có oxi
%mC = 0,22/0,282.100% = 78,01%
%mH = 0,02/0,282.100% = 7,09%
%mN = 0,028/0,282.100% = 9,93% ⇒ %mO = 4,97%
⇒ Đáp án C
Bài 2: Hai chất hữu cơ A và B cùng chứa các nguyên tố C, H, O. Khi đốt cháy mỗi chất đều phải dùng một lượng oxi bằng 8 lần lượng oxi có trong mỗi chất và thu được lượng khí CO2 và H2O theo tỉ lệ khối lượng CO2 so với khối lượng nước = 22/9. Công thức đơn giản của mỗi chất là:
A. C3H6O
B. C2H6O
C. C3H6O
D. CH2O2
Hướng dẫn giải
Gọi công thức tổng quát của A, B là CxHyOz
Phương trình đốt cháy:
CxHyOz + ( x + y/4 - z/2)O2 → x CO2 + y/2H2O
Ta có: mO2 = 8mO (A,B)
⇒ 32( x + y/4 - z/2) = 8.16z ⇒ 4x + y = 18z (1)
⇒ y = 2x (2)
Từ (1)(2) ⇒ z = x/3
⇒ x : y : z = 3 : 6 : 1
Vậy công thức đơn giản nhất cảu hai chất là: C3H6O
⇒ Đáp án A
Bài 3: Đốt cháy hoàn toàn 4,6g một hợp chất hữu cơ A thu được 3,6g H2O. Dẫn khí CO2 sinh ra vào dung dịch nước vôi trong 0,1M thì được 8g kết tủa và dung dịch Y, nhỏ tiếp dung dịch NaOH vào dung dịch Y thì được 3,6g kết tủa nữa. Công thức đơn giản nhất của X là:
A. CH4O
B. C2H6O
C. C3H6O3
D. C3H8O3
Hướng dẫn giải
nH2O = 0,2 mol ⇒ nH = 2. 0,2 = 0,4 mol
Thêm NaOH vào dung dịch Y thu được kết tủa
2NaOH + Ca(HCO3)2 → CaCO3 + Na2CO3 + 2H2O
0,035 ← 0,035
Bảo toàn C: nCO2 = nCaCO3 (1) + 2nCa(HCO3)2 = 0,08 + 0,07 = 0,15 mol
⇒ mC = 0,15.12 = 1,8g
mC + mH < mA ⇒ A có oxi; mO = 4,6 – 1,8 – 0,4 = 2,4g ⇒ nO = 0,15mol
nC : nH : nO = 0,15 : 0,4 : 0,15 = 3 : 8 : 3
Vậy công thức đơn giản nhất là: C3H8O
⇒ Đáp án D
2.2. Dạng 2: Lập công thức phân tử
Bài 1: Một hiđrocacbon A ở thể khí có thể tích gấp 4 lần thể tích của lưu huỳnh đioxit có khối lượng tương đương ở cùng điều kiện. Sản phẩm cháy của A dẫn qua bình đựng nước vôi trong dư thì có 1g kết tủa đồng thời khối lượng bình tăng 0,8g. Công thức phân tử của A là:
A. C3H8
B. C2H8
C. CH4
D. C2H6
Hướng dẫn giải
VA = 4VSO2 và mA = mSO2
⇒ MA = MSO2 : 4 = 16
n ↓ = nCO2 = 0,01 mol ⇒ nC = 0,01 mol
mbình tăng = mCO2 + mH2O = 0,8g
⇒ mH2O = 0,8 – 0,01.44 = 0,36g ⇒ nH = 2.0,36/18 = 0,04 mol
nC : nH = 0,01 : 0,04 = 1 : 4
⇒ Công thức đơn giản nhất của A là: CH4; CTPT là (CH4)n
MA = 16 ⇒ 16n = 16 ⇒ n = 1
Vậy công thức phân tử của A là: CH4
Bài 2: Oxi hóa hoàn toàn 18,6g chất hữu cơ A thu được 52,8g CO2 và 12,6g H2O. Mặt khác khi phân tích lượng chất hữu cơ A thu được khí NH3. Dẫn toàn bộ khí này vào 125ml dung dịch H2SO4 2M thì phần axit dư được trung hòa vừa hết bởi 100ml dung dịch NaOH 3M. Biết dA/kk < 3,25. Công thức phân tử của A là:
A. C6H7N
B. C5H13N
C. C4H11ON
D. C6H15ON
Hướng dẫn giải
nH2SO4 dư = 1/2 nNaOH = 0,15 mol
⇒ nH2SO4 pư = 0,25 – 0,15 = 0,1 mol
nNH3 = 2nH2SO4 = 2.0,1 = 0,2 mol ⇒ nN = 0,2 mol
nC = nCO2 = 1,2 mol; nH = 2nH2O = 1,4 mol
mC + mH + mN = 1,2.12 + 1,4.1 + 0,2.14 = 18,6 = mA
⇒ Trong A không có oxi
nC : nH : nN = 1,2 : 1,4 : 0,2 = 6 : 7 : 1
⇒ Công thức đơn giản nhất của A là: C6H7N; CTPT: (C6H7N)n
Ta có dA/kk < 3,25 ⇒ MA < 94,25
⇒ 93n < 94,25 ⇒ n < 1,01 ⇒ n = 1
Vậy công thức phân tử của A là: C6H7N
⇒ Đáp án A
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Oxi hóa hoàn toàn 6 gam chất hữu cơ X, thu được 6,72 lít CO2 (đktc) và 7,2 gam H2O. Khối lượng nguyên tố oxi trong 6 gam X là?
Câu 2: Oxi hóa hoàn toàn 1,5 gam hợp chất hữu cơ X, thu được 0,224 lít N2 và 0,896 lít CO2 (các khí đều đo ở đktc) và 0,9 gam H2O. Khối lượng nguyên tố oxi trong 1,5 gam X là?
Câu 3: Đốt chấy hoàn toàn 8,2 gam hợp chất hữu cơ X, thu được 3,36 lít CO2 (đktc), 5,3 gam Na2CO3 và 2,7 gam H2O. Khối lượng nguyên tố oxi trong 8,2 gam X là?
Câu 4: Đốt cháy hoàn toàn 8,8 gam hợp chất hữu cơ X (C, H, O). Dẫn sản phẩm cháy lần lượt qua bình (1) đựng dung dịch H2SO4 đặc, bình (2) đụng dung dịch KOH dư, sau thí nghiệm, khối lượng bình (1) tăng 7,2 gam, khối lượng bình (2) tăng 17,6 gam. Thành phần phần trăm khối lượng oxi trong X là?
Câu 5: Đốt cháy hoàn toàn 7,4 gam hợp chất hữu cơ X (C, H, O). Dẫn sản phẩm chảy lần lượt qua bình (1) đựng dung dịch H2SO4 đặc, bình (2) đựng dung dịch Ca(OH)2 dư, sau thí nghiệm, khối lượng bình (1) tăng 5,4 gam, ở bình (2) có 30 gam kết tủa. Thành phần phần trăm khối lượng oxi trong X là?
3.2. Bài tập trắc nghiệm
Câu 1: Trong thành phần phân tử hợp chất hữu cơ nhất thiết phải có nguyên tố
A. cacbon
B. hiđro
C. oxi
D. nitơ.
Câu 2: Chất nào sau đây thuộc loại chất hữu cơ?
A. Al2C4
B. CH4
C. CO
D. Na2CO3.
Câu 3: Phản ứng hóa học của các chất hữu cơ thường
A. xảy ra nhanh và tạo ra hỗn hợp sản phẩm.
B. xảy ra chậm và tạo ra một sản phẩm duy nhất.
C. xảy ra chậm và tạo ra hỗn hợp sản phẩm.
D. xảy ra nhanh và tạo ra một sản phẩm duy nhất.
Câu 4: Đặc điểm chung của hợp chất hữu cơ là
A. tan trong nước, không tan trong dung môi hữu cơ.
B. nhiêt độ nóng chảy, nhiệt độ sôi cao.
C. liên kết trong phân tử chủ yếu là liên kết ion.
D. thường kém bền với nhiệt và dễ cháy.
Câu 5: Đốt cháy hoàn toàn 3 gam hợp chất hữu cơ X (C, H, O). Hấp thụ toàn bộ sản phẩm cháy vào dung dịch Ca(OH)2 dư. Sau thí nghiệm, thu được 10 gam kết tủa và khối lượng dung dịch giảm 3,8 gam so với dung dịch Ca(OH)2 ban đầu. Thành phần phần trăm khối lượng oxi trong X là
A. 26,67%
B. 56,67%
C. 53,33 %
D. 37,04%.
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Mở đầu về hóa học hữu cơ Hóa học 11 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Khái niệm hoá học hữu cơ và hợp chất hữu cơ, đặc điểm chung của các hợp chất hữu cơ
- Phân loại hợp chất hữu cơ theo thành phần nguyên tố (hiđrocacbon và dẫn xuất)
- Các loại công thức của hợp chất hữu cơ: Công thức chung, công thức đơn giản nhất, công thức phân tử và công thức cấu tạo
- Sơ lược về phân tích nguyên tố: Phân tích định tính, phân tích định lượng
