Hoá học 11 Bài 38: Hệ thống hóa về hiđrocacbon
Nội dung bài giảng giúp các em hs hệ thống hóa kiến thức các hiđrocacbon quan trọng: ankan, anken, ankin và ankylbenzen về đặc điểm cấu tạo tính chất vật lý, tính chất hóa học, tính đặc trưng và ứng dụng.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. CTPT và đặc điểm cấu tạo của hidrocacbon
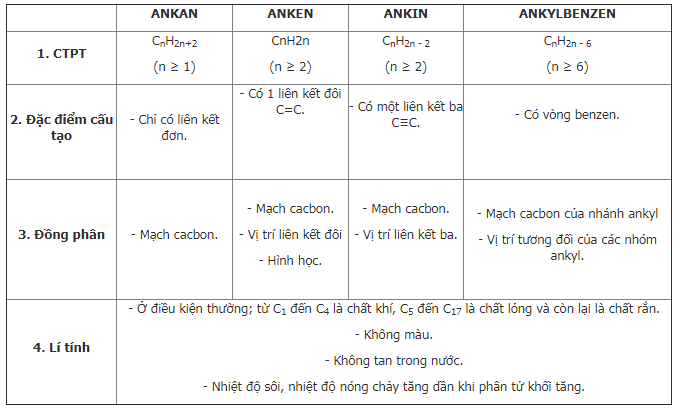
1.2. Tính chất hóa học của hidrocacbon
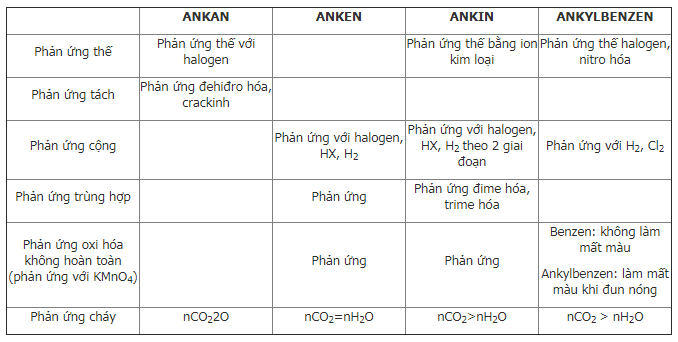
1.3. Sự chuyển hóa giữa các loại hidrocacbon
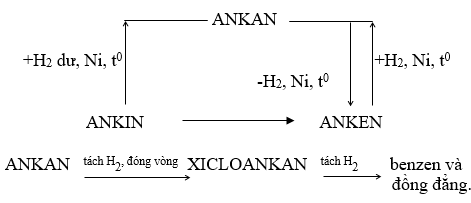
2. Bài tập minh họa
2.1. Dạng 1: Phản ứng oxi hóa hoàn toàn (đốt cháy)
Bài 1: Đốt cháy hoàn toàn 2,24 lít (đktc) hỗn hợp khí X gồm: CH4, C2H4, C2H6, C3H8 và C4H10 thu được 6,16 gam CO2 và 4,14 gam H2O. Số mol của C2H4 trong hỗn hợp X là
A. 0,09.
B. 0,01.
C. 0,08.
D. 0,02.
Hướng dẫn giải
Nhận xét: hỗn hợp X gồm ankan và anken, khi đốt cháy anken cho số mol H2O và CO2 bằng nhau, do đó chênh lệch giữa số mol H2O và CO2 chính là số mol ankan.
nankan =nH2O – nCO2 = \(\frac{{4,14}}{{18}} - \frac{{6,16}}{{44}} = 0,09\)
nanken = nX - nankan = (2,24 : 22,4) - 0,09 = 0,01 mol
Đáp án B.
Bài 2: Để đốt cháy hoàn toàn một lượng hiđrocacbon X cần tối thiểu 7,68 gam O2. Toàn bộ sản phẩm cháy được dẫn qua bình (1) đựng H2SO4 đặc, dư, sau đó qua bình (2) đựng dung dịch Ca(OH)2 dư. Kết thúc thí nghiệm thấy bình (1) tăng 4,32 gam và bình (2) thu được m gam kết tủa. Công thức phân tử của X và giá trị của m lần lượt là
A. C2H6 và 10.
B. C2H4 và 11.
C. C3H8 và 9.
D. CH4 và 12.
Hướng dẫn giải
nO2 = 7,68 : 32 = 0,24 mol
Khối lượng bình 1 tăng chính là khối lượng nước ⇒ nH2O = 4,32 : 18 = 0,24 mol
Bảo toàn nguyên tố O có 2nO2 = 2nCO2 + nH2O ⇒ nCO2 = (2.0,24 - 0,24) : 2 = 0,12 mol < nH2O
Vậy X là ankan và nX = nH2O - nCO2 = 0,12 mol ⇒ số nguyên tử C của X là nCO2 : nX = 1
Kết tủa thu được là CaCO3, ta có nCaCO3 = nCO2 = 0,12 ⇒ mCaCO3 = 12 gam.
Đáp án D.
2.2. Dạng 2: Phản ứng cộng
Bài 1: 0,05 mol hiđrocacbon X làm mất màu vừa đủ dung dịch chứa 8 gam brom cho ra sản phẩm có hàm lượng brom đạt 69,56%. Công thức phân tử của X là
A. C3H6.
B. C4H8.
C. C5H10.
D. C5H8.
Hướng dẫn giải
nBr2 = 8 : 160 = 0,05 mol ⇒ X phản ứng cộng với Br2 tỉ lệ 1:1.
Sản phẩm phản ứng cộng là dẫn xuất đibrom (CxHyBr2) có số mol = 0,05.
\(\% Br = \frac{{160}}{{12x + y + 160}} = 69,56\% \) ⇒ 12x + y = 70 ⇒ C5H10.
Đáp án C.
Bài 2: Một hỗn hợp X gồm 0,12 mol C2H2 và 0,18 mol H2. Cho X đi qua ống sứ đựng bột Ni nung nóng thu được khí Y. Cho Y đi vào dung dịch nước brom dư thấy thoát ra khí Z và khối lượng bình brom tăng m gam. Đốt cháy hoàn toàn Z thu được 0,12 mol CO2 và 0,2 mol H2O. Giá trị của m là
A. 1,64.
B. 5,28.
C. 3,28.
D. 3,48.
Hướng dẫn giải
Cho hỗn hợp X (C2H2 và H2) qua bột Ni nung nóng thu được hỗn hợp Z (C2H6 và H2 dư) và Z’ (C2H4 và C2H2 dư).
Ta có mZ = mC (trong Z) + mH (trong Z) = 12nCO2 + 2nH2O = 1,84 gam
Khối lượng bình brom tăng chính là khối lượng Z’
mZ' = mX - mZ = 0,12.26 + 0,18.2 - 18,4 = 1,64 gam
Đáp án A.
2.3. Dạng 3: Phản ứng crackinh
Bài 1: Crackinh 8,8 gam C3H8 ta thu được hỗn hợp A gồm CH4, C2H4, C3H6, H2 và C3H8 dư chưa bị nhiệt phân. Biết hiệu suất crackinh là 90%. Tỉ khối của hỗn hợp A so với H2 là
A. 11,58.
B. 15,58.
C. 11,85.
D. 18,55.
Hướng dẫn giải
n Ankan = 8,8 : 44 = 0,2 mol ⇒ nAnkan pư = 0,2.90% = 0,18 mol và có 0,02 mol ankan dư.
Nhận xét: số mol sản phẩm mới tạo ra gấp đôi số mol ankan phản ứng.
⇒ số mol khí trong A là 0,18.2 + 0,02 = 0,38 mol.
Bảo toàn khối lượng có mA = mC3H8 = 8,8 gam ⇒ MA = 8,8 : 0,38 = 23,26 gam ⇒ dA/H2 = 11,58
Đáp án A.
Bài 2: Thực hiện phản ứng crackinh hoàn toàn m gam isobutan, thu được hỗn hợp A gồm hai hiđrôcacbon. Cho hỗn hợp A qua dung dịch nước brom có hòa tan 6,4 gam brom. Brom bị mất màu hoàn toàn. Có 4,704 lít khí B (đktc) thoát ra khỏi bình brom, khí này có tỉ khối so với H2 bằng 117/7. Giá trị của m là
A. 5,8 gam
B. 6,96 gam
C. 8,7 gam
D. 10,44 gam.
Hướng dẫn giải
Crackinh hoàn toàn isobutan thu được hỗn hợp CH4 và C3H6.
Số mol anken phản ứng với brom là nanken = nBr2 = 6,4 : 160 = 0,04 mol ⇒ manken = 1,68 gam.
Khối lượng hỗn hợp khí B là 7,02 gam.
Bảo toàn khối lượng có m isobutan = mC3H6 + mB = 1,68 + 7,02 = 8,7 gam.
Đáp án C.
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Hỗn hợp khí X gồm etilen, metan, propin và viyl axetilen có tỉ khối so với H2 là 17. Đốt cháy hoàn toàn 0,05 ml hỗn hợp X rồi hấp thụ toàn bộ sản phẩm cháy vào bình đựng dung dịch Ca(OH)2 (dư) thì khối lượng bình tăng thêm m gam. Giá trị của m là?
Câu 2: Đốt cháy hoàn toàn 20,0 ml hỗn hợp X gồm C3H6, CH4, CO (thể tích CO gấp hai lần thể tích CH4), thu được 24,0 ml CO2 (các thể tích khí đo cùng ở điều kiện nhiệt độ và áp suất). Tỉ khối của X so với khí hiđro là?
Câu 3: Đốt cháy 6,72 lít (đktc) hỗn hợp gồm hai hiđrocacbon X và Y (MY > MX) thu được 11,2 lít CO2 (đktc) vào 10,8 gam H2O. Công thức của X là?
Câu 4: Đốt cháy hoàn toàn hỗn hợp M gồm một ankan X và một ankin Y, thu được số mol CO2 bằng số mol H2O. thành phần phần trăm về số mol của X và Y trong hỗn hợp m lần lượt là?
Câu 5: Dẫn 4,48 lít (đktc) hỗn hợp X gồm hai anken kế tiếp trong dãy đồng đẳng vào lượng dư dung dịch Br2, thấy dung dịch Br2 nhạt màu đồng thời khối lượng bình đựng tăng 7,0 gam. Công thức của 2 anken là?
3.2. Bài tập trắc nghiệm
Câu 1: Chất nào sau đây làm mất màu dung dịch KMnO4 ở điều kiện thường?
A. benzen
B. metan
C. toluen
D. axetilen
Câu 2: Chất nào dưới đây khi phản ứng với HCl thu được sản phẩm chính là 2-clobutan?
A.but-2-in
B. buta-1,3-điện
C. but-1-in
D. but-1-en
Câu 3: Công thức đơn giản nhất của một hi đrocacbon là CnH2n-1. Hiđrocacbon đó thuộc dãy đồng đẳng của
A. ankan
B. ankin
C. anken
D. ankadien
Câu 4: Cho các chất sau: metan, etilen, but-2-in và axetilen. Kết luận đúng là
A. cả 4 chất đều có khả năng làm mất màu dung dịch brom.
B. có hai chất tạo kết tủa với dung dịch bạc nitrat trong dung dịch amoniac
C. có 3 chất có khả năng làm mất màu dung dịch brom.
D. không có chất nào làm nhạt màu dung dịch kali pemanganat.
Câu 5: Hiđro hóa hoàn toàn hiđrocacbon mạch hở X thu được isopentan. Số công thức cấu tạo có thể có của X là
A.4
B. 5
C. 6
D. 7
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Hệ thống hóa về hiđrocacbon Hóa học 11 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Hệ thống hóa kiến thức các hiđrocacbon quan trọng: ankan, anken, ankin và ankylbenzen về đặc điểm cấu tạo tính chất vật lý, tính chất hóa học, tính đặc trưng và ứng dụng.
- Viết phản ứng hóa học, chuyển hóa giữa các hidrocacbon nhận biết và điều chế chúng.
