Hoá học 11 Bài 45: Axit cacboxylic
Bài học giúp các em nắm khái niệm Axit cacboxylic là gì, cách phân loại và gọi tên Axit cacboxylic. Biết về cấu tạo, tính chất hóa học hóa học đậc trưng và ứng dụng của Axit cacboxylic.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Định nghĩa, Phân loại, Danh pháp
a. Định nghĩa
Axit cacboxylic là những hợp chất hữu cơ mà phân tử có nhóm cacboxyl (-COOH) liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hiđro.
Ví dụ: H-COOH, CH3-COOH, C6H5-COOH, HOOC-COOH
b. Phân loại
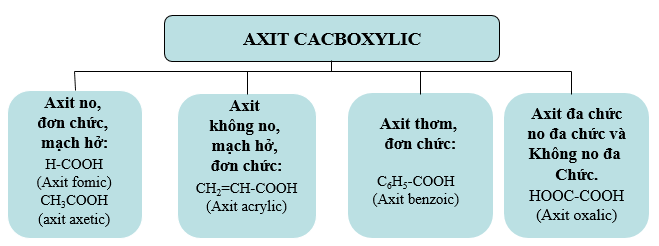
CTTQ axit no đơn chức mạch hở: CnH2n+1COOH (n≥0) hay CnH2nO2 (n ≥1)
c. Danh pháp
Cách gọi tên thay thế của các axit no, đơn chức, mạch hở như sau:
Bước 1: Chọn mạch C dài nhất chứa nhóm -COOH làm mạch chính.
Bước 2: Đánh số từ Cacbon ở nhóm chức -COOH
Bước 3: Axit + tên nhánh+vị trí nhánh+tên hidrocacbon no tương ứng với mạch chính + oic
Ví dụ: 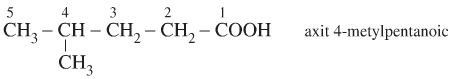

1.2. Đặc điểm cấu tạo
Nhóm cacboxyl có cấu tạo: 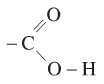
Nhóm C = O không giống trong anđehit và xeton
Nhóm – O – H phân cực hơn nhóm – O – H trong ancol và phenol
Tính axit lớn hơn ancol và phenol
1.3. Tính chất vật lí
Trạng thái: ở điều kiện thường, axit cacboxylic ở trạng thái lỏng hoặc rắn
Nhiệt độ sôi: cao hơn anđehit, xeton và ancol tương ứng có cùng số C
Tính tan: do có liên kết hidro với nước, các axit tan được trong nước.
Axit có vị chua
1.4. Tính chất hóa học
a. Tính axit
Trong dung dịch, axit cacboxylic phân li thuận nghịch:
CH3COOH → H+ + OH-
b. Tác dụng với bazơ, oxit bazơ
CH3COOH + NaOH → CH3COONa + H2O
CH3COOH + ZnO → (CH3COO)2Zn + H2O
c. Tác dụng với muối
Các em chú ý quan sát thí nghiệm sau:
Hiện tượng: Vỏ trứng gà tan ra, có sủi bọt khí không màu.
Giải thích:
CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O
d. Tác dụng với kim loại đứng trước hidro
Zn + 2CH3COOH → (CH3COO)2Zn + H2
e. Phản ứng thế nhóm -OH
RCOOH + R'OH ⇔ RCOOR' + H2O
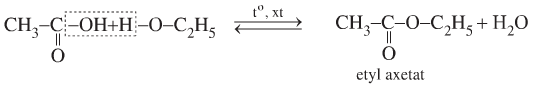
H2SO4 đặc đóng vai trò là chất xúc tác cho phản ứng. H2SO4 đặc hút nước sinh ra để cân bằng dịch chuyển về phía tạo este.
Phản ứng este hóa là phản ứng thuận nghịch.
1.5. Điều chế
a. Phương pháp lên men giấm
C2H5OH + O2 → CH3COOH + H2O
b. Oxi hóa anđehit axetic
CH3CHO + O2 → CH3COOH
c. Oxi hóa Ankan
2CH3CH2CH2CH3 + 5O2 → 4CH3COOH + 2H2O
d. Từ metanol
CH3OH + CO → CH3COOH
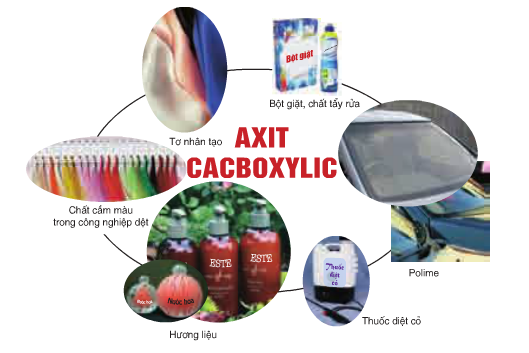
1.6. Ứng dụng
2. Bài tập minh họa
2.1. Dạng 1: Tính axit của cacboxylic
Bài 1: A và B là 2 axit cacboxylic đơn chức. Trộn 1,2 gam A với 5,18 gam B được hỗn hợp X. Để trung hòa hết X cần 90 ml dung dịch NaOH 1M. A, B lần lượt là
A. Axit acrylic, axit axetic.
B. Axit axetic, axit propionic.
C. Axit acrylic, axit propionic.
D. Axit axetic, axit acrylic.
Hướng dẫn giải
maxit = 1,2 + 5,18 = 6,38g; nNaOH = 0,09mol
Gọi công thức chung của 2 axit là RCOOH
nRCOOH = nNaOH = 0,09 mol
⇒ MRCOOH = 6,38/0,09 = 70,8 ⇒ R = 25,8
⇒ A hoặc B phải là CH3COOH
+ Nếu A là CH3COOH ⇒ nA = 1,2 : 60 = 0,02 mol
⇒ nB = 0,09 – 0,02 = 0,07 mol
MB = 5,18 : 0,07 = 74 ⇒ B là: C2H5COOH
+ Nếu B là CH3COOH ⇒ A không có giá trị
⇒ Đáp án B
Bài 2: Cho 2,46 gam hỗn hợp X gồm HCOOH, CH3COOH, C6H5OH tác dụng vừa đủ với 40 ml dung dịch NaOH 1M. Tổng khối lượng muối khan thu được sau khi phản ứng là:
A. 3,52 gam.
B. 6,45 gam.
C. 8,42 gam.
D. 3,34 gam.
Hướng dẫn giải
Hỗn hợp X đều tác dụng với NaOH → muối + H2O
nNaOH = nH2O
Áp dụng định luật bảo toàn khối lượng ta có:
mmuối = mX + mNaOH – mH2O
mmuối = 2,46 + 0,04.40 – 0,04.18 = 3,34g
⇒ Đáp án D
Bài 3: Cho 5,76 gam axit hữu cơ X đơn chức, mạch hở tác dụng hết với CaCO3 thu được 7,28 gam muối của axit hữu cơ. Công thức cấu tạo thu gọn của X là
A. CH2=CH - COOH.
B. CH3COOH.
C. HC C - COOH.
D. CH3 - CH2 - COOH.
Hướng dẫn giải
Đặt công thức của X là: RCOOH
RCOOH → (RCOO)2Ca
R + 45 → 2R + 128 (g)
5,76 → 7,28
⇒ 5,76.(2R + 128) = 7,28.(R+45)
⇒ R = 27 ( C2H3-)⇒ X là: CH2=CH – COOH
⇒ Đáp án A
2.2. Dạng 2: Phản ứng este hóa
Bài 1: Thực hiện phản ứng este hóa m gam CH3COOH bằng một lượng vừa đủ C2H5OH ( xúc tác H2SO4 đặc, đun nóng) thu được 1,76 gam este (H=100%). Giá trị của m là:
A. 2,1
B. 1,2
C. 2,4
D. 1.4
Hướng dẫn giải
CH3COOH + C2H5OH → CH3COOC2H5 + H2O
60g 88g
1,76.60/88 = 1,2g ← 1,76g
maxit = 1,2g ⇒ Đáp án B
Bài 2: Cho hỗn hợp X gồm ancol metylic và hai axit cacboxylic (no, đơn chức, kế tiếp nhau trong dãy đồng đẳng) tác dụng hết với Na, giải phóng ra 6,72 lít khí H2 (đktc). Nếu đun nóng hỗn hợp X (có H2SO4 đặc làm xúc tác) thì các chất trong hỗn hợp phản ứng vừa đủ với nhau tạo thành 25 gam hỗn hợp este (giả thiết phản ứng este hoá đạt hiệu suất 100%). Hai axit trong hỗn hợp X là
A. CH3COOH và C2H5COOH
B. HCOOH và CH3COOH
C. C2H5COOH và C3H7COOH
D. C3H7COOH và C4H9COOH
Hướng dẫn giải
Gọi 2 axit có công thức chung là RCOOH.
Khi tham gia phản ứng với Na ⇒ nancol + naxit = 2nH2 = 0,6 mol
Vì các chất trong hỗn hợp phản ứng este hóa vừa đủ với nhau
⇒ naxit = nancol = 0,3 mol
⇒nRCOOCH3 = naxit = 0,3 mol ⇒ (R + 44 + 15). 0,3 = 25
⇒ 15 (CH3) < R = 24,333 < 29 (C2H5)
Vậy axit kế tiếp nhau là CH3COOH.
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Đốt cháy hoàn toàn x mol axit cacboxylic E, thu được y mol CO2 và z mol H2O (với z = y – x). Cho x mol E tác dụng với NaHCO3 (dư) thu được y mol CO2. Tên gọi của E là?
Câu 2: Trung hòa 3,88 gam hỗn hợp X gồm hai axit cacbocylic no, đơn chức, mạch hở bằng dung dịch NaOH, cô cạn toàn bộ dung dịch sau phản ứng thu được 5,2 gam muối khan. Nếu đốt cháy hoàn toàn 3,88 gam X thì thể tích oxi (đktc) cần dùng là?
Câu 3: Hỗn hợp X gồm axit axetic, axit fomic và axit oxalic. Khi cho m gam X tác dụng với NaHCO3 (dư) thì thu được 15,68 lít khí CO2 (đktc). Mặt khác, đốt cháy hoàn toàn m gam X cần 8,96 lít khí O2 (đktc), thu được 35,2 gam CO2 và y mol H2O (đktc). Giá trị của y là?
Câu 4: Hóa hơi 15,52 gam hỗn hợp gồm một axit no đơn chức X và một axit no đa chức Y (số mol X lớn hơn số mol Y), thu được một thể tích hơi bằng thể tích của 5,6 gam N2 (đo trong cùng điều kiện nhiệt độ, áp suất). Nếu đốt cháy toàn bộ hỗn hợp hai axit trên thì thu được 10,752 lít CO2 (đktc). Công thức cấu tạo của X, Y lần lượt là?
Câu 5: Hỗn hợp X gồm hai axit cacbocylic no, mạch hở Y và Z (phân tử khối của Y nhỏ hơn Z). Đốt cháy hoàn toàn a mol X, sau phản ứng thu được a mol H2O. Mặt khác, nếu cho a mol X tác dụng với lượng dư dung dịch NaHCO3, thì thu được 1,6a mol CO2. Thành phần phần trăm theo khối lượng của Y trong Z là?
3.2. Bài tập trắc nghiệm
Câu 1: Số đồng phân axit ứng với công thức C4H8O2 là
A. 2.
B. 3.
C. 4.
D. 6.
Câu 2: Công thức chung của axit cacboxylic no, đơn chức, mạch hở là
A. CnH2nO2.
B. CnH2n+2O2.
C. CnH2n+1O2.
D. CnH2n-1O2.
Câu 3: Dung dịch axit axetic không phản ứng được với
A. Mg.
B. NaOH.
C. NaHCO3.
D. NaNO3.
Câu 4: Cho các phản ứng sau ở điều kiện thích hợp:
(1) Lên men giấm ancol etylic.
(2) Oxi hóa không hoàn toàn anđehit axetic.
(3) Oxi hóa không hoàn toàn butan.
(4) Cho metanol tác dụng với cacbon oxit.
Trong những phản ứng trên, số phản ứng tạo axit axetic là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 5: Dãy số gồm các chất có nhiệt độ sôi tăng dần từ trái qua phải là:
A. C2H6, C2H5OH, CH3CHO, CH3COOH.
B. C2H6, CH3CHO, C2H5OH, CH3COOH.
C. CH3CHO, C2H6, C2H5OH, CH3COOH.
D. C2H6, CH3CHO, CH3COOH, C2H5OH.
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Axit cacboxylic Hóa học 11 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Khái niệm Axit cacboxylic là gì, cách phân loại và gọi tên Axit cacboxylic.
- Biết về cấu tạo, tính chất hóa học hóa học đậc trưng và ứng dụng của Axit cacboxylic.
