Hoá học 11 Bài 3: Sự điện li của nước - pH và Chất chỉ thị axit-bazơ
Bài học tìm hiểu về các khái niệm Tích số ion của nước, về pH, chất chỉ thị axit - bazơ. Từ đó thông qua các ví dụ và phân tích để các em học sinh biết đánh giá độ axit và độ kiềm của các dung dịch theo nồng độ ion H+ và pH; xác định màu của một số chất chỉ thị trong khoảng pH khác nhau.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Nước là chất điện li rất yếu
a. Sự điện li của nước
- Nước là chất điện rất yếu.
- Phương trình điện li: H2O ⇔ H+ + OH-
b. Tích số ion của nước
- Ở 25OC, hằng số KH2O gọi là tích số ion của nước.
KH2O = [H+]. [OH -] = 10-14
→ [H+] = [OH -] = 10-7
- Nước là môi trường trung tính, nên môi trường trung tính là môi trường trong đó [H+] = [OH] = 10-7
c. Ý nghĩa tích số ion của nước
*Trong môi trường axit
Ví dụ: Tính [H+] và [OH -] của dung dịch HCl 10-3 M.
HCl → H+ + Cl-
10-3 M → 10-3 M
⇒ [H+] = [HCl] = 10-3 M
⇒ \([O{H^ - }] = \frac{{{{10}^{ - 14}}}}{{[{H^ + }]}} = \frac{{{{10}^{ - 14}}}}{{{{10}^{ - 3}}}} = {10^{ - 11}}M\)
⇒ [H+] > [OH-] hay [H+] >10-7 M.
*Trong môi trường bazơ
Ví dụ: Tính [H+] và [OH-] của dung dịch NaOH 10-5 M
NaOH → Na+ + OH-
10-5 M → 10-5 M
⇒ [OH-] = [NaOH] = 10-5 M
⇒ \([{H^ + }] = \frac{{{{10}^{ - 14}}}}{{[O{H^ - }]}} = \frac{{{{10}^{ - 14}}}}{{{{10}^{ - 5}}}} = {10^{ - 9}}M\)
⇒ [OH-] > [H+]
* Kết luận
Vậy [H+] là đại lượng đánh giá độ axít, độ bazơ của dung dịch.
Mt trung tính: [H+] = 10-7 M
Mt bazơ : [H+] <10-7 M
Mt axít: [H+] > 10-7 M
1.2. Khái niệm về pH, chất chỉ thị axit bazơ
a. Khái niệm pH
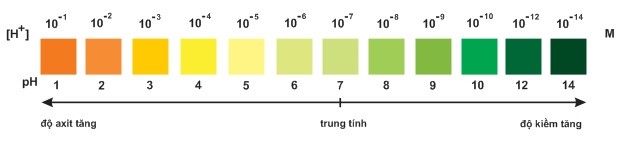
Dung dịch được sử dụng nhiều thường có [H+] trong khoảng 10 -1 à 10-14 M. Để tránh ghi giá trị [H+] với số mũ âm, người ta dùng pH.
Công thức: [H+] = 10-pH M hay pH= -lg [H+]
Nếu [H+] = 10-a M thì pH = a
Ví dụ:
[H+] = 10-3 M ⇒ pH=3 môi trường axít
[H+] = 10-11 M ⇒ pH = 11: môi trường bazơ
[H+]= 10-7 M ⇒ pH = 7 :môi trường trung tính.
b. Chất chỉ thị Axit - bazơ
- Là chất có màu biến đổi phụ thuộc vào giá trị pH của dung dịch
- Ví dụ: Quỳ tím, phenolphtalein
2. Bài tập minh họa
2.1. Dạng 1: Tính pH của dung dịch axit – bazơ mạnh
Trộn 10g dung dịch HCl 7,3% với 20g dung dịch H2SO4 4,9% rồi thêm nước để được 100ml dung dịch A. Tính pH của dung dịch A.
Hướng dẫn giải
Số mol HCl là nHCl = 10.7,3/100.36,5 = 0,02 mol
Số mol H2SO4 là nH2SO4 = 20.4,9/100.98 = 0,01 mol
Phương trình điện li: HCl → H+ + Cl-
H2SO4 → 2H+ + SO42-
Tổng số mol H+ là nH+ = 0,02 + 0,02 = 0,04 mol
CM(H+) = 0,04/0,1 = 0,4 M => pH = 0,4
2.2. Dạng 2: Tính pH của dung dịch axit – bazơ yếu
Hoà tan 1,07g NH4Cl vào nước được 2 lít dung dịch X.
a. Tính pH của dung dịch X biết hằng số phân li bazơ của NH3 là 1,8.10-5.
b. Nếu thêm vào dung dịch X 100 ml dd HCl 0,01M được dd Y. Tính pH của dd Y?
Hướng dẫn giải
a. nNH4Cl = 1,07/53,5 = 0,02 → CM(NH4Cl) = 0,02/2 = 0,01 M
Phương trình điện li:
NH4Cl → NH4+ + Cl-
NH4+ + H2O ⇌ NH3 + H3O+
Ban đầu 0,01
Điện ly: x x x
Sau điện li: 0,01-x x x
Kb = x2/(0,01-x) = 1,8.10-5 → x = 4,24.10-4 → pH = 3,37
b. Phương trình điện li:
HCl → H+ + Cl+
NH4+ + H2O ⇌ NH3 + H3O+
Ban đầu 0,01 0,001
Điện ly x x x
Sau điện li: 0,01-x x x+0,001
Kb = (x.(x+0,001))/(0,01-x) = 1,8.10-5 → x = 3,69.10-4 → pH = 3,43
2.3. Dạng 3: Sử dụng định luật bảo toàn điện tích
Bài 1: Cho 500 ml dung dịch X có các ion và nồng độ tương ứng như sau:
Na+ 0,6M ; SO42- 0,3M ; NO3- 0,1M ; K+ aM.
a) Tính a?
b) Tính khối lượng chất rắn khan thu được khi cô cạn dung dịch X.
c) Nếu dung dịch X được tạo nên từ 2 muối thì 2 muối đó là muối nào? Tính khối lượng mỗi muối cần hòa tan vào nước để thu được 1 lít dung dịch có nồng độ mol của các ion như trong dung dịch X.
Hướng dẫn giải
a. Áp dụng định luật bảo toàn điện tích ta có: 0,6.1 + a = 0,3.2 + 0,1.1 => a = 0,1
b. m = mNa+ + mK+ + mNO3- + mSO42- = 0,3.23 + 0,05.39 + 0,05.62 + 0,15.96 = 26,35 g.
c. Dung dịch được tạo từ 2 muối là Na2SO4 và KNO3
mNa2SO4 = 142.0,3 = 42,6 gam; mKNO3 = 0,1.101 = 10,1 gam.
Bài 2: Trong 2 lít dung dịch A chứa 0,2 mol Mg2+ ; x mol Fe3+ ; y mol Cl- và 0,45 mol SO42-. Cô cạn dung dịch X thu được 79 gam muối khan.
a) Tính giá trị của x và y?
b) Biết rằng để thu được A người ta đã hòa tan 2 muối vào nước. Tính nồng độ mol/lít của mỗi muối trong A.
Hướng dẫn giải
a. Áp dụng định luật bảo toàn điện tích ta có: 2.0,2 + 3.x = 2.0,45 + y.1
→ 3x – y = 0,5 (1)
Cô cạn dung dịch được 79 gam muối khan: 0,2.24 + 56.x + 35,5.y + 0,45.96 = 79
⇔ 56x + 35,5y = 31 (2)
Từ (1),(2) ta có: x = 0,3 và y = 0,4.
b. Dung dịch A có 2 muối là: Fe2(SO4)3 và MgCl2
CM(Fe2(SO4)3) = 0,15 M; CM(MgCl2) = 0,2 M
2.4. Dạng 4: Bài toán về pha loãng, pha trộn dung dịch các chất điện li để đạt được pH định trước
Trộn 3 dung dịch H2SO4 0,1M ; HNO3 0,2M ; HCl 0,3M với thể tích bằng nhau thu được dung dịch A . Lấy 300 ml dung dịch A tác dụng với dung dịch B gồm NaOH 0,2M và Ba(OH)2 0,1M. Tính thể tích dung dịch B cần dùng để sau khi phản ứng kết thúc thu được dung dịch có pH = 1. Coi Ba(OH)2 và H2SO4 phân li hoàn toàn ở 2 nấc.
Hướng dẫn giải
Sau khi trộn 3 dung dịch axit có thể tích bằng nhau ta thu được nồng độ mới của 3 axit là:
CM(HCl) = 0,1 M; CM(HNO3) = 0,2/3; CM(H2SO4) = 0,1/3
Trong 300 ml dung dịch A: nHCl = 0,03 mol; : nH2SO4 = 0,01 mol; nHNO3 = 0,02 mol
Phương trình điện li:
H2SO4 → 2H+ + SO42-
HNO3 → H+ + NO3-
HCl → H+ + Cl-
Tổng mol H+ là nH+ = 0,07 mol
Gọi x là thể tích của dung dịch B cần dùng.
nNaOH = 0,2x; nBa(OH)2 = 0,1x
Phương trình điện li:
NaOH → Na+ + OH-
Ba(OH)2 → Ba2+ + 2OH-
Tổng số mol OH- là: nOH- = 0,4x
Ta có: H+ + OH- → H2O ( Sau phản ứng pH = 1 => dư axit)
Ban đầu: 0,07 0,4x
Pư: 0,4x 0,4x
Sau pư: 0.07-0,4x 0
(0,07-0,4x)/(x+0,3) = 0,1 → x= 0,08 lít
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Cho 10 ml dung dịch X chứa HCl 1M và H2SO4 0,5M. thể tích dung dịch NaOH 1M cần để trung hòa dung dịch X là?
Câu 2: Dung dịch A có chứa 5 ion :Mg2+ ,Ba2+ ,Ca2+ và 0,1 mol Cl- và 0,2 mol NO3 . Thêm dần V ml dung dịch K2CO3 1M vào dung dịch A đến khi thu được lượng kết tủa lớn nhất. V có giá trị là?
Câu 3: Trộn 200 ml dung dịch gồm HCl 0,1M vá H2SO4 0,15M với 300 ml dung dịch Ba(OH)2 nồng độ aM, thu được m gam kết tủa và 500 ml dung dịch có pH = 1. Giá trị của a và m lần lượt là?
Câu 4: Cho 300 ml dung dịch chứa H2SO4 0,1M, HNO3 0,2M và HCl 0,3 M tác dụng với V ml dung dịch NaOH 0,2 M và KOH 0,29M thu được dung dịch có pH = 2. Giá trị của V là?
Câu 5: Trộn V1 lít dung dịch H2SO4 có pH = 3 với 2 lít dung dịch NaOH có pH = 12, thu được dung dịch mới cố pH = 4. Tỉ số V1 : V2 có giá trị là?
3.2. Bài tập trắc nghiệm
Câu 1: Dung dịch có pH = 7 là:
A. NH4Cl.
B. CH3COONa.
C. C6H5ONa.
D. KClO3.
Câu 2: Khi hòa tan trong nước, chất nào sau đây làm cho quỳ tím chuyển màu xanh ?
A. NaCl.
B. NH4Cl.
C. Na2CO3.
D. FeCl3.
Câu 3: Hãy cho biết dãy các dung dịch nào sau đây có khả năng đổi màu quỳ tím sang đỏ (hồng)?
A. CH3COOH, HCl và BaCl2.
B. NaOH, Na2CO3 và Na2SO3.
C. H2SO4, NaHCO3 và AlCl3.
D. NaHSO4, HCl và AlCl3.
Câu 4: Cho các dung dịch muối: Na2CO3 (1), NaNO3 (2), NaNO2 (3), NaCl (4), Na2SO4 (5), CH3COONa (6), NH4HSO4 (7), Na2S (8). Những dung dịch muối làm quỳ hoá xanh là:
A. (1), (2), (3), (4).
B. (1), (3), (5), (6).
C. (1), (3), (6), (8).
D. (2), (5), (6), (7).
Câu 5: Cho các muối sau đây: NaNO3; K2CO3; CuSO4; FeCl3; AlCl3; KCl. Các dung dịch có pH = 7 là:
A. NaNO3; KCl.
B. K2CO3; CuSO4; KCl.
C. CuSO4; FeCl3; AlCl3.
D. NaNO3; K2CO3; CuSO4.
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Sự điện li của nước - pH và Chất chỉ thị axit-bazơ Hóa học 11 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Khái niệm Tích số ion của nước, về pH, chất chỉ thị axit - bazơ
- Đánh giá độ axit và độ kiềm của các dung dịch theo nồng độ ion H+ và pH
- Xác định màu của một số chất chỉ thị trong khoảng pH khác nhau.
Tham khảo thêm
- pdf Hóa học 11 Bài 1: Sự điện ly
- docx Hoá học 11 Bài 2: Axit, bazơ và muối
- docx Hoá học 11 Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li
- docx Hoá học 11 Bài 5: Luyện tập Axit, bazơ và muối và Phản ứng trao đổi ion trong dung dịch các chất điện li
- docx Hoá học 11 Bài 6: Bài thực hành 1 Tính axit-bazơ và Phản ứng trao đổi ion trong dung dịch các chất điện li
