Hoá học 11 Bài 5: Luyện tập Axit, bazơ và muối và Phản ứng trao đổi ion trong dung dịch các chất điện li
Bài học chủ yếu rèn luyện kỹ năng viết phương trình phản ứng trao đổi giữa các chất điện li dạng đầy đủ và dạng ion thu gọn. Vận dụng kiến thức để dự đoán chiều hướng của phản ứng trao đổi giữa các chất điện li và làm một số dạng bài tập cơ bản.
Mục lục nội dung

1. Tóm tắt lý thuyết
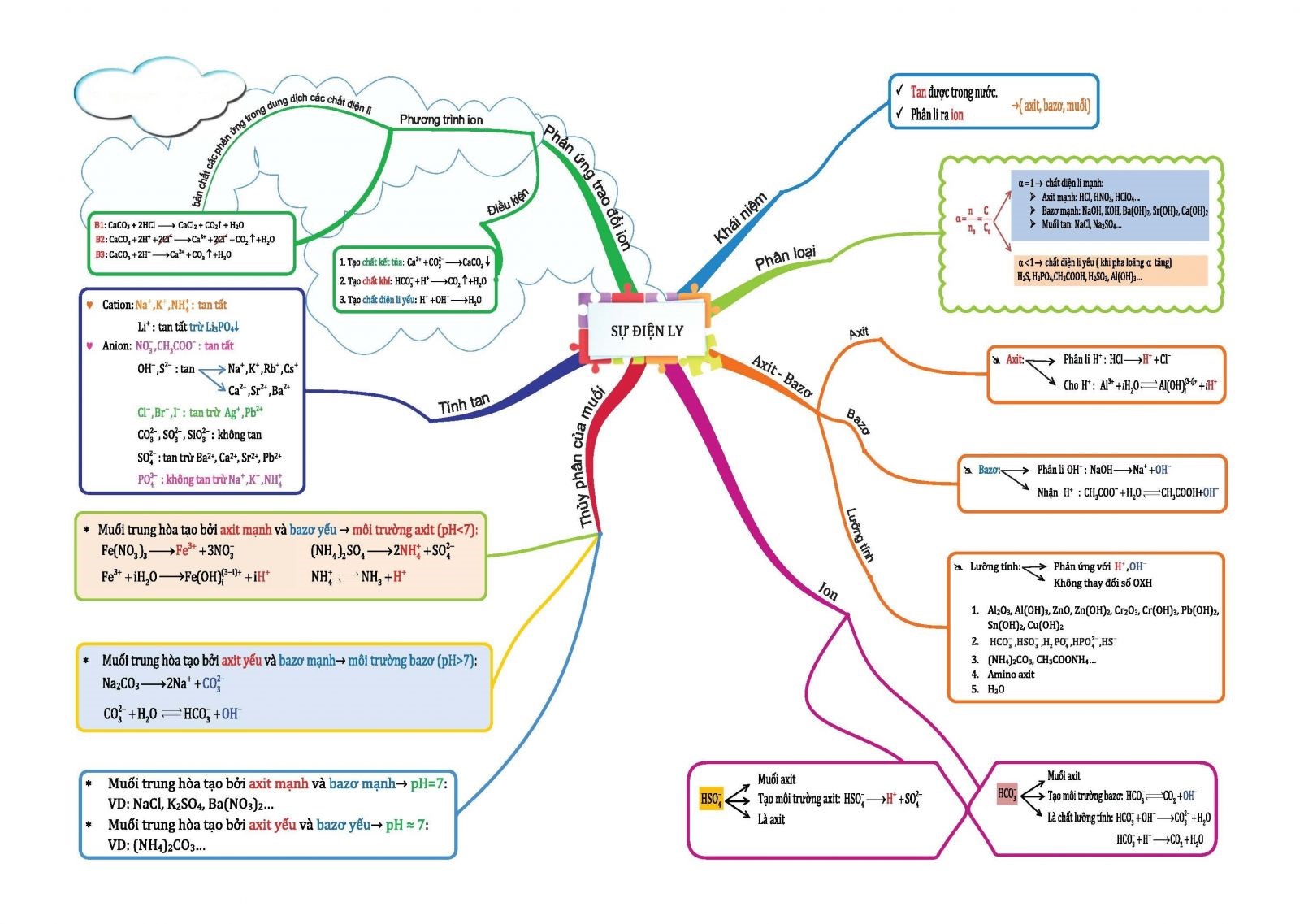
Hình 1: Sơ đồ tư duy Hóa học "Sự điện li"
- Axit là chất khi tan trong nước phân li ra ion H+
- Bazơ là chất khi tan trong nước phân li ra ion OH-
- Hiđroxit lưỡng tính là chất khi tan trong nước vừa có thể phân li theo kiểu axit, vừa có thể phân li theo kiểu bazơ.
- Hầu hết các muối khi tan trong nước phân li hoàn toàn thành cation kim loại (hoặc NH4+) và anion gốc axit.
- Nếu gốc axit còn chứa hiđro axit thì nó sẽ tiếp tục phân li yếu ra cation H+ và anion gốc axit.
2. Bài tập minh họa
2.1. Dạng 1: Chất điện li - Phương trình điện li – Nồng độ các ion trong dung dịch
Bài 1: Cho các chất sau: NaCl; HF; CuSO4; NaOH; Mg(NO3)2; H3PO4; (NH4)3PO4; H2CO3; ancol etylic; CH3COOH; AgNO3; Glucozơ; glyxerol; Al(OH)3; Fe(OH)2; HNO3.
Xác định chất điện li mạnh, chất điện li yếu, chất không điện li? Viết phương trình điện li của các chất (nếu có).
Hướng dẫn giải
- Chất điện li mạnh: NaCl; CuSO4; NaOH; Mg(NO3)2; (NH4)3PO4; AgNO3; HNO3.
Phương trình điện li:
NaCl → Na+ + Cl-
CuSO4 → Cu2+ + SO42-
NaOH → Na+ + OH-
Mg(NO3)2 → Mg2+ + 2NO3-
(NH4)3PO4 → 3NH4+ + PO43-
AgNO3 → Ag+ + NO3-
HNO3 → H+ + NO3-
- Chất điện li yếu: HF; H3PO4; H2CO3; CH3COOH; Al(OH)3; Fe(OH)2.
Phương trình điện li:
HF ⇌ H+ + F-
CH3COOH ⇌ CH3COO- + H+
H3PO4 ⇌ H+ + H2PO4-
Al(OH)3 ⇌ Al3+ + 3OH-
H2PO4- ⇌ H+ + HPO42-
H2CO3 ⇌ H+ + HCO3-
HPO42- ⇌ H+ + PO43-
HCO3- ⇌ H+ + CO32-
Fe(OH)2 ⇌ Fe2+ + OH-
- Chất không điện li: Glucozơ; glyxerol; ancol etylic.
Bài 2: Tính nồng độ mol/lit của các ion có trong dung dịch sau:
a. Hòa tan 4,9 g H2SO4 vào nước thu được 200 ml dung dịch.
b. Trộn lẫn 500 ml dd NaOH 1 M với 200 ml dd NaOH 30% (d = 1,33 g/ml).
c. Trộn 200ml dd Ca(NO3)2 0,5 M với 300 ml dd KNO3 2M.
d. Trộn 100 gam dung dịch Fe2(SO4)3 4% (d=1,25 g/ml) với 120 ml dung dịch FeCl3 0,1 M.
e. Dung dịch HNO2 1 M, biết α = 1,2%.
Hướng dẫn giải
a) Số mol H2SO4 là: nH2SO4 = 4,9/98 = 0,05 mol
CM(H2SO4) = 0,05/0,2 = 0,25 (M)
Phương trình điện li: H2SO4 → 2H+ + SO42-
Nồng độ các ion trong dung dịch là: [H+] = 0,5 M; [SO42-] = 0,25 M
b) 500 ml dd NaOH 1 M có số mol là 0,5 mol
200 ml dd NaOH 3% (d = 1,33 g/ml) có số mol là: 3.200.1,33/40.100 = 0,2 mol
Nồng độ NaOH sau khi trộn là: (0,5+0,2) : (0,5+0,2) = 0,1 (M)
Phương trình điện li: NaOH → Na+ + OH-
Nồng độ các ion trong dùng dịch là: [Na+] = 0,1 M; [OH-] = 0,1 M
c) Số mol Ca(NO3)2 là: nCa(NO3)2 = 0,5.0,2 = 0,1 mol
Phương trình điện li: Ca(NO3)2 → Ca2+ + 2NO3-
Số mol KNO3 là: nKNO3 = 0,3.2 = 0,6 mol
Phương trình điện li: KNO3 → K+ + NO3-
Nồng độ các ion trong dung dịch sau khi trộn là:
[Ca2+] = 0,1/0,5 = 0,2 M; [K+] = 0,6/0,5 = 1,2 M; [NO3-] = (0,2+0,6)/0,5 = 1,6 M
d) Số mol Fe2(SO4)3 là: nFe2(SO4)3 = 4.100/100.400 = 0,01 (mol)
100 gam dung dịch Fe2(SO4)3 4% có thể tích là V = 100/1,25 = 80 ml
Phương trình điện li: Fe2(SO4)3 → 2Fe3+ + SO42-
Số mol của FeCl3 là: nFeCl3 = 0,12.0,1 = 0,012 (mol)
Phương trình điện li: FeCl3 → Fe3+ + 3Cl-
Nồng độ các ion trong dung dịch sau khi trộn là:
[Fe3+] = 0,32/0,2 = 1,6 M; [SO42-] = 0,01/0,2 = 0,05 M; [Cl-] = 0,036/0,2 = 0,18 M
Phương trình điện li:
HNO2 ⇌ H+ + NO2-
Ban đầu: 1 0 0 M
Điện ly: 1.α → α → α M
Sau đl: 1-α → α → α M
Nồng độ các ion trong dung dịch là: [H+] = 0,012 M; [NO2-] = 0,012 M
2.2. Dạng 2: Bài tập phản ứng trao đổi ion trong dung dịch
Dung dịch X chứa các ion: Fe3+, SO42-, NH4+, Cl-. Chia dd X thành hai phần bằng nhau:
- Phần 1: tác dụng với lượng dư dd NaOH, đun nóng thu được 0,672 lít khí (đktc) và 1,07 gam kết tủa.
- Phần 2: tác dụng với lượng dư dd BaCl2, thu được 4,66 gam kết tủa. Tổng khối lượng các muối khan thu được khi cô cạn dd X là (quá trình cô cạn chỉ có nước bay hơi)
Hướng dẫn giải
nNH4+ = nNH3 = 0,672/22,4 = 0,03 mol
nFe3+ = 1,07/107 = 0,01 mol; nSO42- = 4,66/233 = 0,02 mol
Áp dụng đL bảo toàn điện tích: 3.0,01 + 0,03 = 2.0,02 +x ⇒ x = 0,02
m = 0,01.56 + 0,03.18 + 0,02.96 + 0,02.35,5 = 3,73 gam
Khối lượng muối khan trong dung dịch X: 3,73.2 = 7,46 gam
2.3. Dạng 3: Phương pháp, cách tính pH
a. PH với axit, bazo mạnh
Trộn 10g dung dịch HCl 7,3% với 20g dung dịch H2SO4 4,9% rồi thêm nước để được 100ml dung dịch A. Tính pH của dung dịch A.
Hướng dẫn giải
Số mol HCl là nHCl = (10.7,3)/(100.36,5) = 0,02 mol
Số mol H2SO4 là nH2SO4 = (20.4,9)/(100.98) = 0,01 mol
Phương trình điện ly: HCl → H+ + Cl-
0,02 → 0,02 mol
H2SO4 → 2H+ + SO42-
0,01 → 0,02 mol
Tổng số mol H+ là nH+ = 0,02 + 0,02 = 0,04 mol
CM(H+) = 0,04/0,1 = 0,4 M ⇒ pH = 0,4
b. PH với axit, bazo yếu
Cho dd hh X gồm HCl 0,01 M và CH3COOH 0,1M. Biết Ka của CH3COOH = 1,75.10-5 và bỏ qua sự phân li của nước. Giá trị pH của dd X là:
Hướng dẫn giải
Ka = x(0,01+x)/(0,1-x) = 1,75.10-5 ⇒ x = 1,75.10-5 ⇒ pH = 1,99
c. Bài toán về pha loãng, pha trộn dung dịch các chất điện ly để đạt được pH định trước.
Trộn 100 ml dung dịch có pH =1 gồm HCl và HNO3 với 100 ml dung dịch NaOH nồng độ a(mol/l) thu được 200 ml dung dịch A có pH = 12.
a. Tính a
b. Pha loãng dung dịch A bao nhiêu lần để thu được pH = 11
Hướng dẫn giải
a. nH+ = 0,01 mol; nOH- = 0,1a mol
Ta có: H+ + OH- → H2O (Sau phản ứng pH =12 ⇒ dư bazo)
Ban đầu 0,01……0,1a
Pư 0,01……0,01
Sau pư 0....….0,01-0,1a
(0,01-0,1a) : (0,1+0,1) = 0,01 ⇒ a= 0,08 lít
b. số mol NaOH dư: nOH- = 0,002 mol
Gọi x là thể tích nước thêm vào.
Dung dịch sau pha loãng có pH = 10 ⇒ 0,002/(0,2+x) = 0,001 ⇒ x = 1,8
Vậy cần phải pha loãng 10 lần.
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Dùng phản ứng trao đổi ion để tách:
a, ion Mg2+ ra khỏi dung dịch chứa các chất tan Mg(NO3)2 và KNO3
b, ion PO43- ra khỏi dung dịch chứa các chất tan K3PO4 và KNO3
Câu 2: Trong y học,dược phẩm Nabica (NaHCO3) là chất dùng để trung hòa bớt lượng dư axit HCl trong dạ dày.
a, Viết PTHH dưới dạng phân tử và ion rút gọn của phản ứng.
b, Nồng độ axit HCl trong dạ dày 0,035M, tính thể tích dung dịch HCl được trung hòa và thể tích CO2 (đktc) sinh ra khi uống 0,336g NaHCO3.
Câu 3: Hòa tan 0,887g NaCl và KCl trong nước, xử lý dung dịch thu được bằng một lượng dư dung dịch AgNO3 thu được 1,913g kết tủa. Tính thành phần phần trăm của mỗi chất trong hỗn hợp.
Câu 4: Cho 400g dung dịch H2SO4 49% vào nước được 2 lít dung dịch A.
a, Tính nồng độ mol ion H+ trong dung dịch A.
b, Tính thể tích dd NaOH 1,8M cần thêm vào dd A để thu được dung dịch có pH = 1, pH = 7, pH = 13
Câu 5: Cho biết giá trị pH của các dung dịch sau:
Na2CO3, KCl, CH3COONa, NaHSO4, AlCl3, Na2S, C6H5ONa, NH4Cl. Giải thích?
3.2. Bài tập trắc nghiệm
Câu 1: Dãy ion nào sau đây chứa các ion đều phản ứng được với ion OH?
A. H+, NH4+, HCO3-, CO32-
B. Fe2+, Zn2+, HSO4- . SO32-
C. Ba2+, Mg2+, Al, PO43-
D. Fe3+, Cu2+, Pb2+, HS
Câu 2: Ion CO không tác dụng với tất cả các ion thuộc dãy nào sau đây?
A. NH4+, K+, Na+
B. H+, NH4+, K+, Na+
C. Ca2+, Mg2+, Na+
D. Ba2+, Cu2+, NH4+, K+
Câu 3: Dung dịch A có a mol NH4+, b mol Mg2+, c mol SO42- và d mol HSO3-. Biểu thức nào dưới đây biểu thị đúng sự liên quan giữa a, b, c, d?
A. a + 2b = c + d
B. a + 2b = 2c + d
C. a + b = 2c + d
D. a + b = c + d
Câu 4: Dãy nào sau đây gồm các chất vừa tác dụng được với dung dịch axit,vừa tác dụng với dung dịch bazơ ?
A. Al(OH)3, (NH4)2CO3, NH4Cl
B. NaOH, ZnCl2, Al2O3
C. KHCO3, Zn(OH)2 CH3COONH4
D. Ba(HCO3)2, FeO, NaHCO3
Câu 5: Cho các nhóm ion sau:
(1) Na+, Cu2+, Cl, OH
(2) K+, Fe2+, Cl, SO42-
(3) K+, Ba2+, Cl, SO42-
(4) HCl3-, Na+, K+, HSO4-
Trong các nhóm trên,những nhóm tồn tại trong cùng một dung dịch là
A. (1), (2), (3), (4).
B. (2), (3).
C. (2), (4).
D. (2).
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Luyện tập Axit, bazơ và muối và Phản ứng trao đổi ion trong dung dịch các chất điện li Hóa học 11 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Cách viết phương trình phản ứng trao đổi giữa các chất điện li dạng đầy đủ và dạng ion thu gọn
- Vận dụng kiến thức để dự đoán chiều hướng của phản ứng trao đổi giữa các chất điện li
Tham khảo thêm
- pdf Hóa học 11 Bài 1: Sự điện ly
- docx Hoá học 11 Bài 2: Axit, bazơ và muối
- docx Hoá học 11 Bài 3: Sự điện li của nước - pH và Chất chỉ thị axit-bazơ
- docx Hoá học 11 Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li
- docx Hoá học 11 Bài 6: Bài thực hành 1 Tính axit-bazơ và Phản ứng trao đổi ion trong dung dịch các chất điện li
