Hoá học 11 Bài 14: Bài thực hành 2 Tính chất của một số hợp chất nitơ, photpho
Nội dung bài Bài thực hành 2: Tính chất của một số hợp chất nitơ, photpho mục đích là tập cho học sinh cách tiến hành và kĩ thuật thực hiện các thí nghiệm: Phản ứng của dung dịch HNO3 đặc, nóng và HNO3 loãng với kim loại đứng sau hiđro; Phản ứng KNO3 oxi hoá C ở nhiệt độ cao; Phân biệt được một số phân bón hoá học cụ thể (cả phân bón là hợp chất của photpho). Đồng thời rèn kĩ năng Sử dụng dụng cụ, hoá chất để tiến hành được an toàn, thành công các thí nghiệm trên. Quan sát hiện tượng thí nghiệm và viết các phương trình hoá học. Loại bỏ được một số chất thải sau thí nghiệm để bảo vệ môi trường.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Mục đích thí nghiệm
- Xác định tính oxi hóa của HNO3 đặc và loãng
- Phân biệt một số loại phân bón thường gặp
1.2. Kỹ năng thí nghiệm
- Không dùng tay cầm trực tiếp hoá chất.
- Không đổ hoá chất này vào hoá chất khác ngoài chỉ dẫn.
- Không đổ lại hoá chất thừa lại lọ đựng ban đầu.
- Không dùng hoá chất nếu không biết hoá chất gì.
- Không nếm hoặc ngửi trực tiếp hoá chất.
- Khi mở lọ hoá chất và lấy hoá chất không để dây ra bàn, dùng xong đậy nắp lại ngay.
1.3. Cơ sở lý thuyết
a. Thí nghiệm 1: Tính Oxi hóa của HNO3 đặc và loãng
HNO3 có số oxi hóa +5 có thể bị khử thành: N2, N2O, NO, NO2, NH4NO3 tuỳ theo nồng độ HNO3 và khả năng khử của chất tham gia.
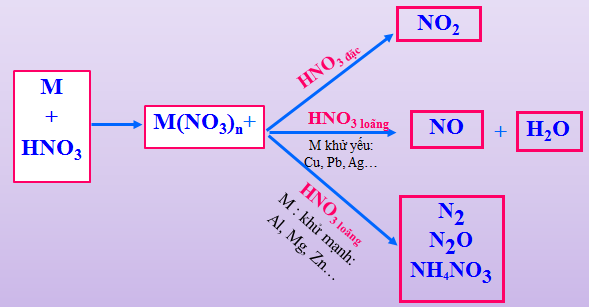
* Lưu ý:
N2O là khí vui, khí gây cười.
N2 không duy trì sự sống, sự cháy
NH4NO3 không sinh ra ở dạng khí, nhưng khi cho kiềm vào dd, thấy có khí mùi khai.
- Oxi hoá hầu hết kim loại (trừ Au, Pt).
3Cu +8HNO3(l) → 3Cu(NO3)2 + 2NO + 4H2O
Cu + 4HNO3đ → Cu(NO3)2 + 2NO2 + 2H2O
- Fe, Al, Cr thụ động hoá với HNO3 đặc, nguội.
b. Thí nghiệm 2: Tính oxi hoá KNO3 nóng chảy
Các muối nitrat đều kém bền bởi nhiệt, khi đun nóng muối nitrat có tính Oxi hóa mạnh.
Sản phẩm phân huỷ phụ thuộc vào bản chất của cation kim loại:
- Kim loại đứng trước Mg → muối Nitrit + O2
Ví dụ: 2KNO3 → 2KNO2 + O2
- Từ Mg đến Cu → Oxit kim loại + NO2 + O2
Ví dụ: 2Cu(NO3)2 → 2CuO + 4NO2 + O2
- Kim loại sau Cu → Kim loại + NO2 + O2
Ví dụ: 2AgNO3 → 2Ag + 2NO2 + O2
c. Thí nghiệm 3: Phân biệt một số loại phân bón hóa học
- Nhận biết gốc SO42- bằng dung dịch Ba2+ với hiện tượng xuất hiện kết tủa trắng BaSO4
- Nhận biết gốc amoni (NH4+) bằng bazơ với hiện tượng sinh ra khí có mùi khai, chính là NH3
1.4. Dụng cụ thí nghiệm, hóa chất
a. Dụng cụ thí nghiệm
- Ống nghiệm, đèn cồn, bông tẩm, bộ giá thí nghiệm
- Giá sắt, chậu cát, kẹp sắt
b. Hóa chất
- Dung dịch HNO3, NaOH, KNO3
- Amoni sunfat, kali clorua và supephotphat kép
- Nước cất, dung dịch NaOH, quỳ tím, dd AgNO3.
1.5. Các bước tiến hành thí nghiệm
a. Thí nghiệm 1: Tính Oxi hóa của HNO3 đặc và loãng
Lấy vào ống nghiệp thứ nhất 0,5 ml dung dịch HNO3 đặc (68%) và ống nghiệm thứ hai 0,5ml dung dịch HNO3 loãng (15%). Cho vào ống nghiệp một mảnh nhỏ đồng kim loại.
Nút các ống nghiệm bằng bông tẩm dd NaOH. Đun nhẹ ống nghiệm thứ hai.
b. Thí nghiệm 2: Tính oxi hoá KNO3 nóng chảy
Lấy một ống nghiệm chịu nhiệt khô và cặp thẳng đứng trên giá sắt, rồi đặt giá sắt trong chậu cát.
- Bỏ một ít tinh thể KNO3 vào ống nghiệm và đốt cho muối nóng chảy.
- Khi muối bắt đầu phân hủy (nhìn thấy các bọt khí xuất hiện) vẫn tiếp tục đốt nóng ống nghiệm, đồng thời dùng kẹp sắt bỏ một hòn than nhỏ đã được đốt nóng đỏ vào ống.
c. Thí nghiệm 3: Phân biệt một số loại phân bón hóa học
- Cách tiến hành: Nhận biết các dung dịch đựng trong các lọ mất nhãn đánh số 1,2,3: KCl, Na3PO4; (NH4)2SO4
+ Bước 1: Trích dẫn 3 dung dịch ra 3 mẫu thử
+ Bước 2: Nhỏ dung dịch NaOH vào lần lượt 3 mẫu thử
+ Bước 3: Nhỏ dung dịch AgNO3 vào các mẫu thử còn lại
2. Báo cáo thực hành
2.1. Thí nghiệm 1: Tính Oxi hóa của HNO3 đặc và loãng
Video 1: So sánh phản ứng của Đồng và axit nitric đặc, axit nitric loãng
- Hiện tượng:
+ Ở ống nghiệm chứa Cu và HNO3 đặc xuất hiện khí màu nâu đỏ, nhiều, dung dịch chuyển sang màu xanh.
+ Ở ống nghiệm chứa Cu và HNO3 loãng xuất hiện khí không mùa, trong không khí chuyển thành nâu đỏ, với lượng khí ít hơn ở ống nghiệm chứa HNO3 đặc. Dung dịch cũng có màu xanh lam.
- Giải thích:
+ Cho mảnh Cu vào ống nghiệm chứa HNO3 đặc có khí NO2 màu nâu bay ra vì HNO3 đặc bị khử đến NO2. Dung dịch chuyển sang màu xanh do tạo ra Cu(NO3)2
+ Cho mảnh Cu vào ống nghiệm chứa HNO3 loãng và đun nóng có khí NO không màu bay ra, sau chuyển thành NO2 màu nâu đỏ. Dung dịch chuyển sang màu xanh lam của Cu(NO3)2
- Phương trình hóa học:
Cu + 4HNO3 đặc → Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO + 4H2O
2.2. Thí nghiệm 2: Tính oxi hoá KNO3 nóng chảy
Thí nghiệm này, các em có thể sử dụng NaNO3 để thay thế KNO3 cũng được vì đây đều là muối nitrat của kim loại kiềm
Video 2: Nhiệt phân muối Natri nitrat
- Hiện tượng: Que đóm bùng cháy kèm theo tiếng nổ lách tách.
- Giải thích: Que đóm sẽ bùng cháy trong KNO3 nóng chảy, có tiếng nổ lách tách đó là do KNO3 nhiệt phân giải phóng khí oxi.
2KNO3 → 2KNO2 + O2
2.3. Thí nghiệm 3: Phân biệt một số loại phân hóa học
- Hiện tượng và giải thích
+ Nhỏ dd NaOH vào các ống nghiệm, đun nhẹ, ống nào có mùi khai NH3 bay ra, làm quì tím ẩm hoá xanh: nhận biết được (NH4)2SO4.
+ Nhỏ dd AgNO3 vào 2 ống nghiệm đựng KCl, Na3PO4, ống nghiệm nào xuất hiện kết tủa màu vàng Ag3PO4: nhận biết được Na3PO4, kết tủa trắng là KCl
+ Phương trình hóa học
NH4+ + OH- → NH3 (khí mùi khai) + H2O
AgNO3 + KCl → AgCl (kết tủa trắng) + KNO3
AgNO3 + AgNO3 → không xảy ra phản ứng
3. Luyện tập
Câu 1: Người ta thu đầy khí X rồi nút bình bằng nút cao su có cắm một ống thủy tinh vuốt nhọn (hình bên). Sau đó cho đầu ống thủy tinh vào trong một chậu nước có phenolphlatein thấy các tia nước màu hồng bắn mạnh trong bình. Khí X là
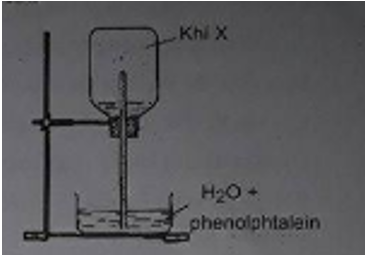
A. HCl.
B. O2.
C. N2.
D. NH3.
Câu 2: Để điều chế chất X trong phòng thí nghiệm người ta cho dung dịch H2SO4 đặc tác dụng với muối Y, trong bình cầu có cổ cong (hình dưới). Bình cầu dùng để thu chất X được làm lạnh bằng nước đủ. X có thể là chất nào trong các chất sau:

A. HNO3.
B. H2S.
C. HBr.
D. HI.
Câu 3: Cho Cu và dung dịch H2SO4 loãng tác dụng với chất X (một loại phân bón hóa học), thấy thoát ra khí không màu hóa nâu trong không khí. Mặt khác khí X tác dụng với dung dịch NaOH thì có mùi khai thoát ra. Chất X là
A. amophot.
B. amoni nitrat.
C. urê.
D. natri nitrat.
Câu 4: Trong mỗi chén sứ X, Y, Z đựng 1 loại muối nitrat. Nung các chén ở nhiệt độ cao trong không khí đến khi phản ứng xảy ra hoàn toàn. Sau khi lam nguội chaens nhận thấy: trong chén X không còn lại dấu vết gì, trong chén Y còn lại chất rắn màu trắng, trong chén Z còn lại chất rắn màu đen tan trong dung dịch HCl tạo dung dịch có màu lam. Các muối nitrat lần lượt là
A. NH4NO3, Zn(NO3)2, AgNO3.
B. Hg(NO3)2, Ca(NO3)2, Fe(NO3)2.
C. NH4NO3, NaNO3, Cu(NO3)2.
D. NH4NO3, KNO3, Fe(NO3)2.
4. Kết luận
Nôi dung bài thực hành sẽ giúp cho các em có một tiết học thực hành thật vui, và ứng dụng nhiều lý thuyết vào trong thực tế, từ đó sẽ có cái nhìn bao quát và cụ thể hơn cho bài học.
